1. Спин-спиновое взаимодействие – ковалентная связь (донорно-акцепторное взаимодействие) и металлическая связь.
2. Электростатическое взаимодействие – ионная связь и межмолекулярные связи.
Валентность элемента – мера его способности образовывать химические связи. В образовании связей принимают участие электроны внешних уровней для s - и p -элементов; внешних и предвнешних – для d - и f -элементов.
В рамках теории Льюиса, атомы в реакциях стремятся к образованию устойчивой восьмиэлектронной оболочки инертного благородного газа ns2np6, расположенного в том же периоде (правило октета).
Элементы VIIA группы для завершения октета могут приобрести только один электрон или отдать семь электронов внешнего слоя:
CI + 1 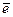 = CI (CI−) CI – 7
= CI (CI−) CI – 7 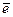 = CI+7
= CI+7
3 s 23 p 53 s 23 р 63 s 23 p 52 s 22 p 6
Элементы VIA группы могут для приобретения устойчивой восьмиэлектронной оболочки либо отдать шесть электронов (S0 − 6 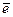 = S+6), либо присоединить два электрона (S0 + 2
= S+6), либо присоединить два электрона (S0 + 2 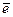 = S−2). Элементы IA и IIA групп могут только отдавать свои валентные электроны:
= S−2). Элементы IA и IIA групп могут только отдавать свои валентные электроны:
Ко – 1 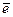 = К+ (3 s 23 p 54 s 1 ® 3 s 23 p 6 ).
= К+ (3 s 23 p 54 s 1 ® 3 s 23 p 6 ).
Согласно представлениям Льюиса, валентность соответствует числу электронных пар, обобществляемых атомом для завершения октета электронов внешнего электронного слоя. Для элементов VIIA группы образуется одна ковалентная связь, VIA – две, VA – три, IVA – четыре ковалентные связи.
 2015-02-27
2015-02-27 318
318








