Каждый студент получает индивидуальное типовое задание на приготовление эталонного раствора – Приготовить V мл эталонного раствора N-ной примеси. В качестве примера рассмотрим расчет для задачи: приготовить 200 мл эталонного раствора хлорид иона.
Алгоритм действий.
1. Из таблицы или ГФХ, ГФХI находят концентрацию эталонного раствора данной примеси. СЭ хлорид-иона = 0,0002%.
2. Определяем массу стандартного вещества (в нашем примере NaCl), которая должна находится в заданном объёме (в нашем примере 200 мл):
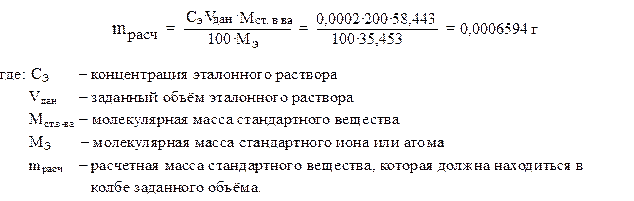
3. Определение навески. Взвесить такую массу NaCl и поместить в заданную колбу сразу нельзя, поскольку при приготовлении эталонных растворов и взвешивании на аналитических весах с точностью до 0,001 г минимальная масса навески равна 0,5 г, а минимальный отмериваемый объём равен 1 мл. В нашем примере ясно, что расчетную массу стандартного вещества надо увеличить в 1000 раз, что составит 0.659 г (n = 1000).
4. Выбор схемы разведения. Дальнейшее планирование зависит от наличия мерной посуды и конкретные решения могут быть различными. Общая схема разведений не превышает обычно два этапа (см. рис. 5)
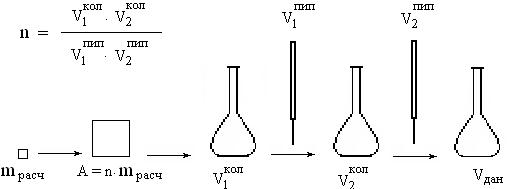
Р и с. 5. Общая схема приготовления эталонных растворов
Например,
1-ый вариант – приготовление в 1 этап: 0,659 г NaCl растворяют в воде в мерной колбе емкостью 1 л и доводят водой до метки. 1 мл полученного раствора помещают в мерную колбу емкостью 200 мл и доводят водой до метки.
2-ой вариант – приготовление в 2 этапа: 0.659 г NaCl растворяют в воде в мерной колбе емкостью 100 мл и доводят водой до метки. 5 мл полученного раствора помещают в мерную колбу емкостью 100 мл и доводят водой до метки. 2 мл полученного раствора помещают в мерную колбу емкостью 200 мл и доводят водой до метки.
Ниже в качестве примера описаны опыты по приготовлению всех восьми эталонных растворов.
 2015-02-27
2015-02-27 854
854








