Задачи этой темы решаются с использованием законов Вант-Гоффа, Рауля, уравнений ионного произведения воды и водородного показателя.
Задача с использованием уравнения закона Вант-Гоффа: 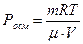
Задача 5
Определите молярную массу неэлектролита, если в 5 л раствора содержится 2,5 г его. Осмотическое давление этого раствора при 20 оС равно 0,23×105 Па.
| Дано: | Си | Решение |
| V = 5 л m = 2,5 г Росм = 0,23·× 105 Па t = 20 oC | 5 ·× 10–3 м3 2,5 ·× 10–3 кг Т = 273о + 20о293К R = 8,31 Дж/моль·к | 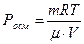
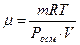
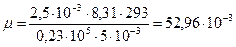
|
| m =? |
кг×Дж/моль×к×К кг×н×м×к×м2 кг
[m] = --------------------- = ---------------- = -------
Н/м2×м3 н×моль×к×м3 моль
Ответ: молярная масса неэлектролита равна 52,96×10–3 кг/моль.
Задача 6
Решение задач с использованием второго закона Рауля.
Δtкип. = кэбл · С
Δtзам. = ккр · С
Пример:
Определите температуру кипения и замерзания раствора, состоящего из 1000 г воды и 100 г сахара.
Дано:
кэбл = 0,52о
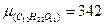 г/моль
m = 100 г
А = 1000 г
ккр = 1,86 о г/моль
m = 100 г
А = 1000 г
ккр = 1,86 о
| tокип. р-ра = tокип. р-ля + Δtкип.
tокип. р-ра = 100о + tкип.
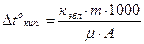
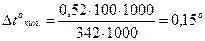
|
| tкип =? tзам =? | tокип. = 100о + 0,15 = 100,15о Δtзам.р-ра = 0о – Δtзам. |
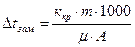
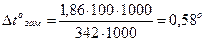
tокип. = 0о – 0,58о = – 0,58о
Ответ: температура кипения раствора сахара 100,15о, а температура замерзания того же раствора –0,58о.
Задачи с использованием полного произведения воды [H+]·[OH–] =
10–14 и водородного показателя рН = –lg[H+].
Задача 7
Дано:
| [OH–] = 1,38·10–6 г·ион/л | рН = –lg[H+] |
| рН =? | Находим концентрацию ионов водорода из ионного произведения воды |
[H+]·[OH–] = 10–14
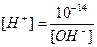
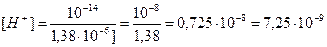
рН = –lg7,25·10–9 = –(lg7,25 + lg10–9) = –(0,86 – 9) = 0,86 + 9 = 8,14
Ответ: рН = 8,14, значит среда щелочная.
 2015-02-04
2015-02-04 454
454








