В реакции первого порядка скорость реакции пропорциональна концентрации одного реагента. Для нее 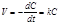 . (8.10) Особенность реакции первого порядка заключается в том, что равным промежуткам времени отвечают равные доли С0 / С прореагировавшего вещества (рис. 8.2). Время t, нужное для того, чтобы прореагировала половина С0, называется периодом полупревращения: подставляя в уравнение t 1/2 = t и С = С0 /2, получим:
. (8.10) Особенность реакции первого порядка заключается в том, что равным промежуткам времени отвечают равные доли С0 / С прореагировавшего вещества (рис. 8.2). Время t, нужное для того, чтобы прореагировала половина С0, называется периодом полупревращения: подставляя в уравнение t 1/2 = t и С = С0 /2, получим: 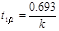 , (8.16) т.е. для реакции первого порядка период полупревращения t 1/2 не зависит от начальной концентрации и служит характеристикой скорости таких реакций.
, (8.16) т.е. для реакции первого порядка период полупревращения t 1/2 не зависит от начальной концентрации и служит характеристикой скорости таких реакций. 
Рис. 8.2. Зависимость lgС от времени для реакции первого порядк. 8.11. Реакция второго порядка
Выражение скорости для реакции второго порядка имеет вид: 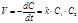 (8.17)
(8.17)
или 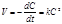 . (8.18)
. (8.18)
(8.22) Период полупревращения для реакции второго порядка не остается постоянным, а обратно пропорционален начальной концентрации (рис. 8.3): 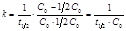 . (8.23)
. (8.23)

Рис. 8.3. Зависимость 1/C от времени для реакции второго порядка
 2015-02-04
2015-02-04 465
465








