Кипение представляет собой фазовый переход, при котором происходит превращение жидкости в пар, причем пузырьки пара образуются во всем объеме жидкости.
Температурой кипения жидкости называют ту температуру, при которой давление насыщенного пара над данной жидкостью равно внешнему. При этой температуре и соответствующем ей давлении насыщенного пара устанавливается равновесие между жидкой и газообразной фазами (скорость испарения равна скорости конденсации), и обе эти фазы могут сосуществовать в течение длительного времени. Если жидкость – индивидуальное вещество и внешнее давление не меняется, то кипение ее в открытом сосуде происходит при постоянной температуре до тех пор, пока полностью не исчезнет жидкая фаза. Температура, при которой данная жидкость кипит в условиях давления 101325 Па, называют нормальной температурой кипения.
Замерзание (затвердевание) представляет собой фазовый переход, при котором происходит превращение жидкости в твердое вещество, частицы которого (кристаллы) образуются во всем объеме жидкости.
|
|
|
Температурой замерзания (кристаллизации) жидкости называют ту температуру, при которой давление насыщенного пара над жидкостью равно давлению насыщенного пара над выпадающими из нее кристаллами твердой фазы. При этой температуре и соответствующем ей давлении насыщенного пара устанавливается равновесие между жидкой и твердой фазами (скорость кристаллизации равна скорости плавления) и обе эти фазы могут сосуществовать в течение длительного времени. Если жидкость – индивидуальное вещество и внешнее давление остается постоянным, то при ее охлаждении температура будет оставаться постоянной, соответствующей температуре замерзания, до тех пор, пока не произойдет полное затвердевание.
Для того, чтобы сместить равновесие в сторону кристаллизации надо понизить температуру, т.к. кристаллизация – это экзотермический процесс. Если растворить в жидкости какое-то вещество, концентрация ее уменьшится и в системе жидкость – твердая фаза усилится процесс плавления. Отсюда вытекает зависимость (II закон Рауля):
Повышение температуры кипения, а также понижение температуры кристаллизации разбавленных растворов прямо пропорционально моляльности раствора и не зависит от природы вещества.
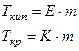
где: 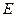 иК – эбуллиоскопическая и криоскопическая константы (зависят от природы растворителя, не зависят от природы вещества и концентрации)
иК – эбуллиоскопическая и криоскопическая константы (зависят от природы растворителя, не зависят от природы вещества и концентрации)
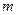 - моляльность раствора.
- моляльность раствора.
Свойства и механизмы формирования жидких растворов разнообразны, поэтому создание единой теории растворов связано со значительными трудностями. Известны несколько точек зрения на природу растворов: физическая, химическая и комплексная.
|
|
|
Механизм растворения в рамках комплексной модели можно представить в виде трех стадий: 1) ориентация полярных молекул растворителя вокруг частиц растворяемого вещества, образование ион – дипольных связей; 2) разрыв связей в растворяемом веществе; 3) сольватация ионов в растворе.
Две первые стадии связаны с затратой энергии, а третья с ее выделением. Соотношение энергий определяет теплоту растворения, и тем самым экзотермичность или эндотермичность процесса растворения.
Известно, что по своей структуре жидкости занимают промежуточное положение между газами, в которых молекулы располагаются хаотично, и кристаллами, где частицы находятся на определенных расстояниях друг от друга в узлах кристаллической решетки. В жидкостях сохраняются некоторые элементы упорядоченной структуры. Например, считается, что вода частично сохраняет структуру льда, в котором каждая молекула имеет водородные связи с четырьмя соседними молекулами.
При образовании раствора вследствие появления новых сил взаимодействия между частицами структура чистых жидкостей нарушается. Возникает новая структура с другим расположением частиц и иным взаимодействием между ними. Все это сильно влияет на процессы, протекающие в растворах.
Свойства раствора существенно зависят от его состава. Поэтому важнейшими характеристиками раствора являются концентрации его компонентов. Способы выражения концентраций различны. Чаще других используют:
1. Молярную долю – отношение количества i – компонента ni, содержащегося в растворе, к общему количества вещества в системе n1.
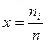
2.Объемная доля – отношение объема, занимаемого i – компонентом Vi, к общему объему системы V.
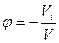
3. Массовая доля - отношение массы i – компонента (mi) к общей массе системы m.
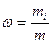
4. Молярная концентрация - отношение количества i – компонента ni, к объему, занимаемому системой V.
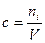
Молярную концентрацию выражают в моль/м3, моль/л. Допускается обозначение М.
5. Моляльная концентрация или моляльность - отношение количества i – компонента ni, к массе растворителя mр.
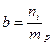
Моляльную концентрацию выражают в моль/кг. Например, под термином «одномоляльный раствор» понимается раствор, содержащий 1 моль растворенного вещества в 1 кг растворителя.
6. Молярная концентрация эквивалента – отношение количества эквивалентов i вещества, к объему, занимаемому системой.
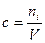
Молярную концентрацию эквивалента выражают в моль/м3, моль/л. Допускается обозначение н.
При внесении растворяемого вещества в растворитель процесс растворения какое – то время идет самопроизвольно, т.е. раствор остается ненасыщенным, значит в раствор может переходить еще некоторое количество вещества. Когда раствор становится насыщенным, то в такой системе неопределенно долго могут сосуществовать без каких – либо изменений раствор и избыток растворяемого вещества. Равновесное состояние может быть нарушено только в результате изменения температуры, давления или введения других веществ. В перенасыщенном растворе концентрация вещества выше, чем в насыщенном (при данной температуре и давлении), его можно приготовить осторожным и медленным охлаждением насыщенного при высокой температуре раствора соли слабой кислоты (тиосульфатов и ацетатов щелочных металлов). Перенасыщенный раствор представляет собой систему, находящуюся в кажущемся равновесии. Встряхивание или внесение в него кристаллов того же вещества, которое находится в растворе, вызывает кристаллизацию, происходит выделение избытка растворенного вещества, и раствор становится насыщенным.
Растворимость данного вещества равна его концентрации в насыщенном растворе. Для разных веществ она колеблется в значительных пределах. Абсолютно нерастворимых веществ нет. Растворимость зависит от природы вещества, его агрегатного состояния и внешних условий (температуры, давления и др.). При растворении некоторых веществ имеет место контрактация – сжатие объема системы: объем раствора получается несколько меньше суммы объемов растворяемого вещества и растворителя. Так, при смешении 48 объемов воды с 52 объемами этилового спирта при температуре 293К вместо 100 объемов смеси получается только 96,3. Это объясняется взаимодействием спирта и воды с образованием гидратов, а также взаимоуплотнением их молекул в пространстве.
|
|
|
Газы способны растворяться в жидкостях, но не безгранично, а до некоторого предела, соответствующего образованию насыщенного раствора. После достижения состояния насыщения устанавливается динамическое равновесие между раствором и находящимся над ним газом. Это равновесие характеризуется тем, что в единицу времени число молекул газа, входящих в жидкость через ее поверхность, равно числу молекул газа, выходящих из жидкости.
Растворение газов почти всегда сопровождается выделением теплоты (вследствие сольватации их молекул). Согласно принципу Ле Шателье, растворимость газов понижается при повышении температуры и увеличивается при охлаждении.
Закон Генри (1803) выражает зависимость растворимости газов от давления: растворимость данного газа в жидкости пропорциональна его давлению над жидкостью: С = Кр,
где с – концентрация газа в жидкости, к – коэффициент пропорциональности, зависящий от природы газа, р – давление газа над раствором.
Объем растворенного газа не зависит от внешнего давления, поскольку при увеличении давления в одинаковое число раз возрастает концентрации растворенного газа и газа над раствором. Таким образом, растворимость газа в жидкости пропорциональна его парциальному давлению.
Парциальное давление азота примерно в 4 раза превышает парциальное давление кислорода. Поэтому по мере увеличения давления раствор обогащается азотом.
|
|
|
При нормальном давлении в 100 мл крови растворено около 1 мл азота, а при давлении в 3 атм – 3 мл. Повышенное содержание азота в крови является причиной кессонной болезни. Она нередко возникает у водолазов после глубоководного погружения и у летчиков при перегрузках. В период пребывания в зоне повышенного давления происходит перенасыщение азотом крови и тканей организма. При попадании в зону пониженного давления снижается растворимость, и происходит выделение пузырьков азота из крови и тканей. Непосредственной причиной кессонной болезни является закупорка мелких кровеносных сосудов азотом и невозможность его быстрого выделения из организма через кровь и легкие.
Существует связь между содержанием данного компонента в растворе и парциальным давлением насыщенного пара этого компонента. Эта зависимость выражается законом Рауля: парциальное давление насыщенного пара любого компонента идеального раствора линейно возрастает с увеличение его молярной доли в растворе.
Идеальными будут такие растворы, образование которых из компонентов, взятых в одинаковом агрегатном состоянии и в любых соотношениях, не сопровождается изменением объема и тепловым эффектом, а изменение энтропии равно изменению энтропии при смешении идеальных газов:
ΔV = 0 ΔH = 0 ΔSс = ΔSиг
Закон Дальтона: При растворении смеси газов в жидкости каждый газ растворяется прямо пропорционально своему парциальному давлению.
В зависимости от природы жидкостей, составляющих систему, различают:
системы, состоящие из неограниченно смешивающихся жидкостей (вода и этиловый спирт, вода и уксусная эссенция)
системы, состоящие из жидкостей ограниченно растворяющихся друг в друге (вода и анилин, вода и эфир)
системы из практически нерастворимых друг в друге жидкостей (вода и бензин, вода и ртуть).
Температура, при которой ограниченная растворимость переходит в неограниченную, называется критической температурой растворения.
Взаимную растворимость компонентов можно повысить или понизить введением третьего компонента.
Например, анилин может неограниченно смешиваться с водой при всех температурах, если в системе присутствует достаточное количество йодида лития (т. к. эта соль одинаково хорошо растворяется в обоих жидкостях). Иногда введение третьего компонента позволяет перевести однородный раствор в двухфазный. Например, для того чтобы выделить этиловый спирт из его водного раствора, достаточно добавить кристаллический поташ и энергично встряхнуть. После отстаивания раствор разделяется на два несмешивающихся слоя.
Как правило, рассматриваются растворы твердых веществ в жидкостях. Свойства растворов подчиняются трем закона сформулированным Раулем и четвертым – Вант Гоффом.
Свойства разбавленных растворов не зависящих от природы вещества, а зависящие только от его концентрации называются коллигативными. К ним относятся осмотическое давление, понижение давления насыщенного пара над раствором, понижение температуры кристаллизации и повышение температуры кипения раствора.
В соответствии с законом Рауля давление насыщенного пара над разбавленным раствором ниже, чем над чистым растворителем.
Важную роль в организме растении и животных играет явление осмоса. Осмос – процесс односторонней диффузии растворителя сквозь полупроницаемую мембрану от раствора с меньшей концентрацией к раствору с большей концентрацией.
В разбавленных растворах осмос не зависит в явной форме от вида растворенного вещества и растворителя. Решающее значение имеет концентрация раствора. Материалы, сквозь которые проходит растворитель и не проходит растворенное вещество, называют полупроницаемыми.
Уравнение Вант – Гоффа:
π= сΤR
Величина осмотического давления зависит от концентрации растворенного вещества.
Нарушение осмоса и изменение осмотического давления в организме ведет к нежелательным последствиям. Понижение осмотического давления вызывается введением в организм большого количества избыточной воды или в результате потери солей, например с потом. Оно может вызвать рвоту, судороги, а в тяжелых случаях – привести к гибели организма. Повышенное осмотическое давление связано с введением в организм избытка солей и перераспределением воды, в результате в тканях скапливается избыток солей и возникают отеки.
Осмотическое давление является одной из причин движения воды растениях и ее подъема от корней до вершины. С листьев растений под действием атмосферных процессов вода испаряется, ее потеря компенсируется осмотическим всасыванием из клеток стебля.
Раствор в отличие от чистого растворителя, не замерзает при постоянной температуре. Кристаллы начинают выделяться при какой – то одной температуре, по мере понижения температуры количество их растёт, пока весь раствор не превратится в твердую фазу. Температуру, при которой в результате охлаждения раствора начинается образования кристаллов, называют температурой замерзания раствора. при температуре замерзания кристаллы растворителя находятся в равновесии с раствором данного состава.
Опыт показывает, что разбавленный раствор замерзает при более низкой температуре, чем чистый растворитель. Разность между температурами замерзания растворителя и раствора получила название понижением температуры замерзания Δt.
Δt = kс, где
k – криоскопическая константа. Это величина численно равная понижению температуры замерзания одномоляльного раствора при условии, что он остается идеальным. а растворенное вещество не диссоциирует и не ассоциирует. Криоскопическая константа зависит от природы растворителя и не зависит от природы растворенного вещества. Для воды – 1,86; для фенола – 7,27, для бензола – 5,10 Ккг/моль. Это означает, что при растворении в этих растворителях одного и того же вещества равной концентрации наибольшее понижение температуры замерзания будет наблюдаться в феноле, наименьшее в воде.
В результате понижения давления пара над раствором нелетучего вещества повышается температура кипения раствора. Наличие растворенного вещества вызывает повышение температуры кипения раствора.
Δt = Ес, где
Е – эбуллиоскопическая постоянная. Она зависит только от растворителя. Для воды 0,51, фенола – 3,04.
Необходимо помнить, что температура кипения растворов выше по сравнению с температурой кипения воды. Поэтому ожоги от кипящих растворов более болезненны, чем ожоги от кипящих растворителей.
Лекция 4 «Электролитическая диссоциация в водном растворе»
Вещества – электролиты это:
1. растворимые основания – щелочи,
2. кислоты,
3. растворимые соли.
Оксиды к электролитам не относятся, т. к. они не просто растворяются в воде, а вступают с ней в химическую реакцию, образуя гидроксид, который и диссоциирует.Нередко встречаются вещества, в молекулах которых наблюдается два вида связи. Например, в гидроксиде натрия – NaOH натрий связан с гидроксогруппой ионной связью, а водород с кислородом – ковалентной. В молекуле серной кислоты H2SO4 связь водорода с кислотным остатком более полярна, чем связь серы с кислородом. В нитрате алюминия Al(NO3)3 алюминий связан с кислотным остатком ионной связью, а атомы азота с атомами кислорода – ковалентной. В таких случаях распад молекулы на ионы происходит по месту ионной или наиболее полярной связи, для расщепления которых требуется меньше энергии.
Из сказанного следует, что ионы могут быть образованы не только из отдельных атомов, но и групп атомов. Например SO4 2- , NO3-, OH-.
Для количественной характеристики электролитической диссоциации вводится понятие степени диссоциации (a):
n
a = -----, где n – число молекул вешества, распавшихся на ионы;
N N – число молекул вещества, введенного в раствор.
В зависимости от степени диссоциации все электролиты условно делят на сильные (a =1) и слабые (a<1). Степень диссоциации зависит от природы электролита, температуры и концентрации раствора.
К сильным электролитам относятся: сильные минеральные кислоты НСl, H2SO4, HNO3, HMnO4 и др., гидроксиды щелочных и щелочно-земельных металлов, и все растворимые соли.
К слабым электролитам относятся: практически все органические вещества, слабые кислоты H2CO3, H2S, HNO2, H2SiO3, H3PO4, оставшиеся основания, и многие бинарные соединения Н2О, оксиды и др.
При написании уравнений электролитической диссоциации необходимо учитывать, что:
диссоциация многоосновных кислот и многокислотных оснований происходит ступенчато;
уравнение диссоциации сильных электролитов по первой ступени записывают, как необратимый процесс, а по всем последующим – как обратимый (исключение гидроксиды щелочных и щелочно-земельных металлов).
Например, HNO3 ® H+ + NO3- Ba(OH)2 ® Ba2+ + 2OH-
H2SO4® H+ + HSO4 - NH4H2PO4 ®NH4+ + H2PO42-
HSO4- «H+ + SO4 2- H2PO4- «H+ + HPO42-
K2CO3 ® 2K+ + CO3 HPO42- «H+ + PO43-
слабые электролиты диссоциируют обратимо по всем ступеням:
H2CO3 «H+ + HCO3- Pb(OH)2 «PbOH+ + OH-
HCO3- «H+ + CO32- PbOH+ «Pb2+ + OH-
Амфотерные гидроксиды являются слабыми электролитами и диссоциируют как по типу основания, так и по типу кислоты:
Zn(OH)2 «ZnOH+ +OH- Zn(OH)2 + H2O «H+ +H[Zn(OH)4]-
ZnOH+ «Zn2+ + OH- H[Zn(OH)4]- «H+ + [Zn(OH)4]2-
Для характеристики слабых электролитов применяют величину, называемую константой диссоциации.
Например,
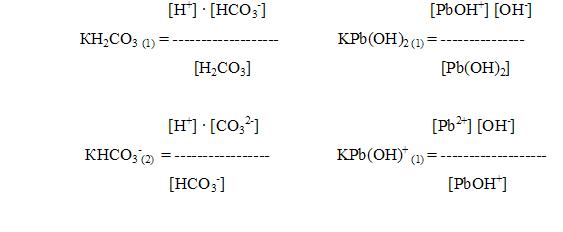
Константа диссоциации и степень диссоциации находятся в математической зависимости (закон разбавления): с уменьшением концентрации раствора (С) степень диссоциации (a) электролита возрастает.
Кд. = С · a2
Из закона разбавления могут быть получены формулы, связывающие константу диссоциации слабого электролита, степень диссоциации и концентрацию иона (Сиона). Действительно, так как
К = (СКt CAn) / C и CKt = CAn, то Сиона = Ö К/С.
Нетрудно видеть, что также Сиона = a С и Сиона = К/С.
 2015-02-04
2015-02-04 3560
3560
