Свойство растворов сохранять определенное значение рН называется буферным действием. Растворы, обладающие буферными свойствами, называют буферными.
В широком смысле буферными называют системы, поддерживающие определенное значение какого-либо параметра при изменении состава. Буферные растворы могут быть кислотно – основные – поддерживают постоянство рН при введении кислот или оснований, окислительно – восстановительными – сохраняют постоянным потенциал систем при введении окислителей или восстановителей. Буферный раствор представляет собой сопряженную пару. Например:
1. слабая кислота и соль этой кислоты и сильного основания (уксусная кислота и ацетат натрия – ацетатный буфер)
2. слабое основание и соль этого основания и сильной кислоты (гидроксид аммония и хлорид аммония – аммиачный буфер)
3. растворы, содержащие соли многоосновных кислот (гидрофосфат натрия и дигидрофосфат натрия – фосфатный буфер)
Рассмотрим механизм поддержания рН в ацетатном буфере. Там протекают реакции:
СН3СООН ↔ СН3СОО- + Н+
СН3СООNa ↔ СН3СОО- + Na+
Первая реакция практически полностью подавляется из-за большой концентрации ацетат ионов, вызванной диссоциацией сильного электролита – ацетата натрия.
Если к раствору добавить сильную кислоту, то ионы водорода будут взаимодействовать с анионами с образованием молекул уксусной кислоты и реакция среды не изменится. Если к раствору добавить сильное основание, то гидроксид-ионы будут взаимодействовать с ионами водорода (или молекулами уксусной кислоты). Образование воды не повлияет на рН среды. Пошедшие на реакцию с ОН – ионами ионы водорода будут компенсированы за счет смещения равновесия реакции диссоциации уксусной кислоты вправо.
Константа электролитической диссоциации уксусной кислоты:
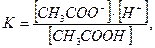 откуда (1)
откуда (1)
Значение концентрации водородных ионов:
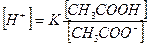 (2)
(2)
Степень электролитической диссоциации уксусной кислоты незначительна, поэтому в растворе преобладают ее недиссоциированные молекулы. Концентрация недиссоциированных молекул будет почти равна концентрации кислоты. Тогда концентрацию недиссоциированной кислоты можно заменить общей концентрацией кислоты в растворе:
[СН3СООН] = [кислота],
а концентрацию ацетатных ионов — концентрацией соли в растворе:
[СН3СОО-] = [соль].
Подставив эти величины в выражение (2), получим уравнение расчёта [Н+] для буферного раствора:
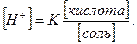 (3)
(3)
Величина К (константа электролитической диссоциации кислоты) при данных условиях постоянна.
Прологарифмируя уравнение (3) получим:
рН = 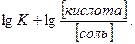
Применяя такие же рассуждения, для смеси слабого основания и соли сильной кислоты можно вывести уравнение:
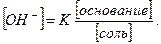
рН = 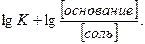
Из уравнений следует, что рН буфера зависит от величины константы слабой кислоты или слабого основания, а также от соотношения концентраций компонентов буферных смесей.
Поскольку константа электролитической диссоциации при данных условиях постоянна, то рН буферного раствора будет зависеть только от отношения концентрации кислоты (или основания) и соли, взятых для приготовления буферной смеси и не зависит от абсолютного значения этих концентраций. Опыт показывает, что даже при значительном разбавлении буферных растворов в 10-20 раз рН мало изменяется.
Способность буферных растворов противодействовать резкому изменению рН ограничена. Предел, в котором проявляется буферное действие, называется буферной емкостью (В). Численно буферная емкость определяется количеством моль-эквивалентов сильной кислоты или основания, которое надо добавить к 1 л буферной смеси, чтобы изменить величину рН на единицу.
Величина буферной емкости зависит от концентрации компонентов буферной смеси и их отношения. Чем выше концентрация компонентов буферной смеси, тем больше ее емкость. Максимальное буферное действие наблюдается в случае, если кислота и соль находятся в растворе в эквивалентных количествах.
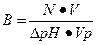 ,
,
где N – концентрация (моль/л) добавленной кислоты (щелочи); V – объем (л) кислоты (щелочи); ΔрН – абсолютная величина изменения рн буферной системы в результате добавления кислоты (щелочи); Vр – объем буферной смеси (л).
Наличие буферных смесей в живых организмах определяет постоянство рН крови, молока, клеточного сока растений. Карбонатная и фосфатная буферные системы имеют большое значение в регулировании биохимических процессов в организме, почве, в процессах пищевой промышленности.
 2015-02-04
2015-02-04 1063
1063
