Адиабатический процесс. Если сосуд с расширяющимся газом теплоизолировать от окружающей среды, то теплообмен будет отсутствовать, т. е. Q = 0. Процесс, происходящий при соблюдении этого условия, называется адиабатическим.
Уравнение первого начала термодинамики при учете условия Q = 0 принимает вид
0 = ΔU + A или A = – ΔU. (109)
Следовательно, при адиабатическом процессе работа совершается только за счет внутренней энергии газа. При адиабатическом расширении газ совершает работу, а его внутренняя энергия и, следовательно, температура падают. При адиабатическом сжатии работа газа отрицательна (внешняя среда производит работу над газом), внутренняя энергия и температура газа возрастают.
Адиабатический процесс можно реализовать практически и при отсутствии хорошей теплоизоляции. Но тогда необходимо вести процесс столь быстро, чтобы за время его осуществления не произошел сколько-нибудь существенный теплообмен с внешней средой.
Теплоемкость при адиабатическом процессе
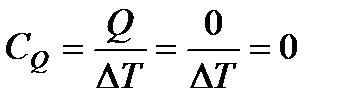 . (110)
. (110)
Выведем уравнение кривой, изображающей адиабатический процесс на рV- диаграмме. Уравнение состояния моля газа имеет вид:
pV = RT. (111)
При бесконечно малом изменении состояния совершаемая работа А = pdV, а изменение внутренней энергии, согласно (83), Δ U –> CVdT. Подставляя эти значения A и ΔU в уравнение первого начала термодинамики (109), получим:
CVdT + pdV = 0. (112)
Это есть уравнение адиабаты в дифференциальной форме. Поскольку оно содержит все три параметра — р, V и Т, — то для исключения одного из них воспользуемся уравнением состояния (111), предварительно продифференцировав его:
pdV + Vdp = RdT. (113)
Умножая уравнение (112) на R, а (113) — на СV искладывая их, получим
(CV + R)pdV + CVVdp = 0. (114)
Принимая во внимание, что для идеального газа CV + R = = Ср, разделим уравнение (114) на произведение CVpV и введем обозначение
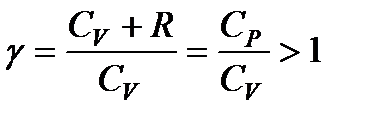 . (115)
. (115)
Тогда (114) примет вид
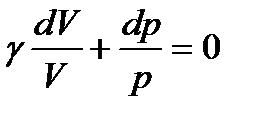 . (116)
. (116)
Учитывая, что постоянный множитель γ можно внести под знак дифференциала, преобразуем (116) к виду
d[γlnV + lnp] = 0. (117)
Отсюда следует, что величина, стоящая в скобках, должна быть постоянной. Обозначим эту константу как ln(const). Тогда
γlnV + lnp = ln(const). (118)
Учитывая, что γlnV = lnVγ и потенцируя выражение (118), получим
pVγ = const. (119)
Это и есть уравнение адиабаты. Его также называют уравнением Пуассона.
Поскольку γ > 1. то кривая, изображаемая этим уравнением (рис. 39), идет круче изотермы pV = const, которая для сравнения показана на том же чертеже штрих-пунктиром. Видно, что при адиабатическом расширении из точки I кривая (119) опускается ниже изотермы, т. е. газ охлаждается, а при адиабатическом сжатии кривая (119) поднимается выше изотермы, т. е. газ нагревается. Величина работы адиабатического процесса может быть особенно просто вычислена с помощью уравнения (109):
A = -CVΔT = -CV(T2 – T1) = CV(T1 – T2). (120)
Используя формулу (115), выражение (120) можно преобразовать к виду:
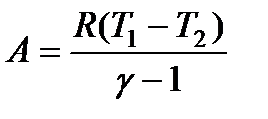 (121)
(121)
Для нахождения же конечной температуры T2 можно, комбинируя (111) и (119), получить соотношение
TVγ–1 = const. (122)
Для одноатомного газа Cv = 12,5 кДж/(кмоль*К), СP = Cv + R = 20,8 кДж/(кмоль*К), и показатель степени адиабаты равен примерно 1,67. Для двухатомных газов при обычных температурах 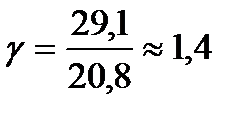 . Для многоатомных газов при возбуждении их колебательных степеней свободы теплоемкости СP и Cv имеют еще большие значения и показатель степени адиабаты
. Для многоатомных газов при возбуждении их колебательных степеней свободы теплоемкости СP и Cv имеют еще большие значения и показатель степени адиабаты
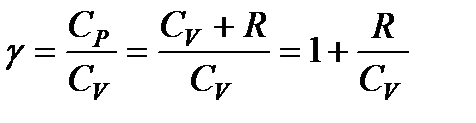 (123)
(123)
еще ближе к единице.
В быстроходных двигателях внутреннего сгорания и при истечении газов через сопла реактивных двигателей процесс расширения газа протекает настолько быстро, что его можно считать практически адиабатическим и рассчитывать по уравнению (119).
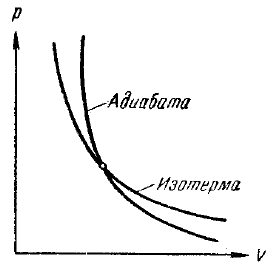
Рис. 39. Адиабата и изотерма
Так как у> 1, то из (122) следует, что при адиабатическом сжатии газ нагревается, а при адиабатическом расширении — охлаждается. Это явление находит применение в дизелях, где воспламенение горючей смеси осуществляется путем адиабатического сжатия. Нагревание газа при адиабатическом сжатии объясняется тем, что во время сжатия над газом производится работа, которая идет на увеличение его внутренней энергии. А так как внутренний энергия идеального газа зависит только от температуры, то это увеличение внутренней энергии проявляется в повышении его температуры. Аналогично объясняется и охлаждение газа при адиабатическом расширении. Охлаждение газа при адиабатическом расширении используется в холодильных машинах.
 2015-02-15
2015-02-15 21451
21451
