- характеристика элемента кремния: электронное строение, возможные степени окисления, основные соединения: оксид, гидроксид. Аморфный и кристаллический кремний.
Кремний – элемент 3-го периода и IVA-группы Периодической системы, порядковый номер 14. Электронная формула атома 1s22s22p63s 23p2 = [ 10Ne]3s 23p 2. Характерная степень окисления в соединениях +IV.
Шкала степеней окисления кремния:
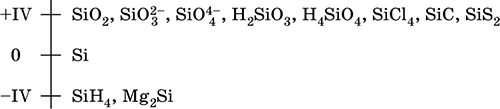
Электроотрицательность кремния невысока для неметаллов (2,25). Проявляет неметаллические (кислотные) свойства; образует оксиды, кремниевые кислоты, очень большое число солей – силикатов в виде цепей, лент и трехмерных сеток тетраэдров [SiO 4], бинарные соединения. В настоящее время широко развивается химия органических соединений кремния со связями Si – С и кремнийорганических полимеров – силиконов и силиконовых каучуков со связями Si – Si, Si – О и Si – С.
Важнейший элемент неживой природы, второй по химической распространенности. Встречается только в связанном виде. Жизненно важный элемент для многих организмов.
Кремний Si – Простое вещество. Крупнокристаллический – темно-серый, с металлическим блеском, весьма твердый, очень хрупкий, непрозрачный, тугоплавкий, распространенный полупроводник. Кристаллическая решетка – атомная, связи Si – Si очень прочные. Аморфный – белый или желто-коричневый (с примесями, в основном Fe), химически более активен. Устойчив на воздухе (покрыт прочной оксидной пленкой), не реагирует с водой. Реагирует с HF (конц.), щелочами. Окисляется кислородом, хлором. Восстанавливается магнием. Спекается с графитом. Промышленно важным является сплав с железом – ферросилиций (12–90 % Si). Применяется как легирующая добавка в стали и сплавы цветных металлов, компонент полупроводниковых материалов для микроэлектроники, основа силиконов.
Уравнения важнейших реакций:
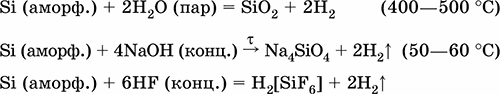

Получение в промышленности: восстановление SiCl 4или SiO 2при прокаливании:
SiCl 4+ 2Zn = Si + 2ZnCl 2
SiO 2+ 2Mg = Si + 2MgO
(последняя реакция может быть осуществлена и в лаборатории, после обработки соляной кислотой остается аморфный кремний).
Диоксид кремния SiO 2 – Кислотный оксид. Белый порошок (кварцевый песок) и прозрачные кристаллы, природный продукт окрашен примесями (кремнезём) – в виде обычного песка и камня (кремень). Кристаллическая решетка атомная, каждый атом кремния окружен четырьмя атомами кислорода [Si(O) 4], а каждый атом кислорода – двумя атомами кремния [O(Si) 2]. Имеет несколько кристаллических модификаций (все минералы), важнейшие — кварц, тридимити кристобалит, редко встречающиеся и искусственно полученные — китит, коэсит, стишовит, меланофлогит, волокнистый кремнезём.Тугоплавкий, при медленном охлаждении расплава образуется аморфная форма – кварцевое стекло (в природе минерал лешательеит). Наиболее химически активна аморфная форма.
Практически не реагирует с водой (из раствора осаждается гидрат SiO 2nН 2O), распространенными кислотами. Кварцевое стекло разъедается в HF (конц.). Реагирует со щелочами в растворе (образует ортосиликаты) и при сплавлении (продукты — метасиликаты). Легко хлорируется в присутствии кокса. Восстанавливается коксом, магнием, железом (в доменном процессе).
Применяется как промышленное сырье в производстве кремния, обычного, термо– и химически стойкого стекла,
фарфора, керамики, абразивов и адсорбентов, наполнитель резины, смазок, клеев и красок, компонент строительных связующих растворов, в виде монокристаллов кварца – основа генераторов ультразвука и точного хода кварцевых часов. Разновидности кварца (горный хрусталь, розовый кварц, аметист, дымчатый кварц, халцедон, оникси др.) – драгоценные, полудрагоценные или поделочные камни.
Уравнения важнейших реакций:

Полигидрат диоксида кремнияSiO 2nH 2O – Кремниевые кислоты с переменным содержанием SiO 2и Н 2O. Белый, аморфный (стекловидный) полимер с цепочечным, ленточным, листовым, сетчатым и каркасным строением. При нагревании постепенно разлагается. Очень мало растворим в воде. Над осадком в растворе существует мономерная слабая ортокремниевая кислота H 4SiO4(тетраэдрическое строение, sр 3-гибридизация), растворимость 0,00673 г/100 г Н 2O при 20 °C. При стоянии раствора идет поликонденсация и медленно образуются вначале кремниевые кислоты H 6Si 2O7, H 2Si 2O 5, H 10Si 2O 9, затем гидрозоль [H 2SiO 3] n(золь метакремниевой кислоты) и, наконец, гидрогель SiO 2 • nН 2O (n < 2). При высушивании гидрогель переходит в силикагель SiO 2 • nН 2O (n < 1). Скорость гелеобразования максимальна в слабокислотной среде.
Переводится в раствор действием концентрированных щелочей. По остальным химическим свойствам подобен SiO 2. В природе – минералы опал и халцедон (агат, яшма). Мономерная метакремниевая кислота H 2SiO 3не получена.
Уравнения важнейших реакций:
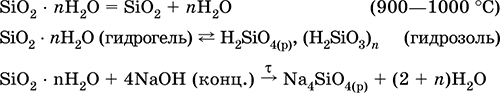
Получение: вытеснение сильной кислотой из раствора силиката, например:
K 2SiO 3+ 2НCl + (n – 1) Н 2O = 2КCl + SiO 2nН 2O ↓
Метасиликат натрияNa 2SiO 3 – Оксосоль. Белый, при нагревании плавится без разложения. Растворяется в холодной воде (сильный гидролиз по аниону). Концентрированный раствор – коллоидный («жидкое стекло», содержит гидрозоль SiO 2nН 2O). Разлагается в горячей воде, реагирует с кислотами, щелочами, углекислым газом.
Применяется как компонент шихты в производстве стекла, специальных цементов и бетонов, входит в состав силикатных красок и клея, холодных глазурей, алюмосиликатных катализаторов, при изготовлении бумаги и картона, силикагеля, синтетических цеолитов. Уравнения важнейших реакций:
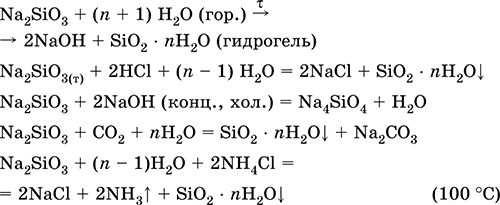
Получение: сплавление соды с песком
Na 2SiO 3+ SiO 2= СO 2+ Na 2SiO 3 (1150 °C)
Силикаты. Кремний в степени окисления +IV находится, помимо SiO 2, в весьма многочисленных и часто очень сложных по составу и строению силикат-ионах (так, кроме жетасиликат-иона SiO 3 2-и ортосиликат-иона SiO 4 4-известны ионы Si 2O 7 6-, Si 3O 9 6-, Si 2O 10 4- и др.). Для простоты записи все силикаты изображают как содержащие ион SiO 3 2-.
Насыщенный раствор силикатов натрия и калия (вязкое «жидкое стекло») используется как силикатный клей.
Силикаты натрия и кальция входят в состав стекла; его получают сплавлением кварца SiO 2, известняка СаСO 3и соды Na 2CO 3:
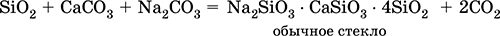
Часто состав стекла выражают через оксиды, например, обычное стекло Na 2O СаО • 6SiO 2.
Среди силикатных минералов отметим глины (алюмосиликаты), очень чистая глина — каолин Al 2O 32SiO 2 • 2Н 2O используется для изготовления фарфора.
Силикаты и алюмосиликаты применяют в промышленности при производстве керамики, цемента, бетона и других строительных материалов.
Тетрахлорид кремнияSiCl 4. Бинарное соединение. Бесцветная жидкость, обладает широким интервалом жидкого состояния. Молекула имеет тетраэдрическое строение (sр 3-гибридизация). Термически устойчив. «Дымит» во влажном воздухе. Полностью гидролизуется водой. Разлагается щелочами. Восстанавливается водородом, натрием, цинком. Хлорирует оксид алюминия.
Применяется в производстве особо чистого кремния для полупроводниковой техники.
Уравнения важнейших реакций:
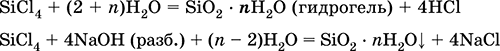
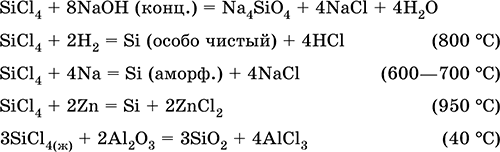
Получение в промышленности – хлорирование кремния или кварцевого песка SiO 2.
Кристаллический кремний — это основная форма, в которой используется кремний при производстве фотоэлектрических преобразователей и твердотельных электронных приборов методами планарной технологии. Активно развивается использование кремния в виде тонких плёнок (эпитаксиальных слоёв) кристаллической и аморфной структуры на различных подложках.
 2015-02-15
2015-02-15 5947
5947
