Химическая термодинамика. Позволяет ответить на вопросы: возможно или невозможно протекание в системе желательных или нежелательных процессов, в каких условиях возможна или невозможна та или иная реакция? Это достигается путем установления связи между превращениями веществ (например, изменение их химического или фазового состава) и превращениями химической энергии в теплоту, работу или другие формы энергии.
Таким образом, химическая термодинамика описывает химические процессы, сопровождаемые выделением или поглощением теплоты и производством работы, посредством исследования изменений энергетического состояния компонентов (т.е. изменения количества теплоты и работы) в процессе перехода из одного состояния (1) в другое (2). Она рассматривает, в частности, переход энергии от одних веществ к другим, энергетические эффекты химических процессов, а в итоге устанавливает критерии направления и предела протекания любых химических процессов.
Химическая термодинамика позволяет рассчитать конечный результат – равновесный состав реакционной смеси, оценить максимально возможный выход продуктов реакции и подобрать оптимальные условия ее проведения. Для биологических систем термодинамика позволяет оценить вероятность протекания процесса по тому или иному механизму, отбросив те из них, которые противоречат ее законам. Это способствует лучшему пониманию биологических процессов, протекающих, например, в продуктах питания.
|
|
|
Объектами исследования химической термодинамики являются тепловые балансы физико-химических процессов, фазовые (плавление, испарение, возгонка и др.) и химические равновесия. Поэтому определение тепловых эффектов реакций – одна из основных задач химической термодинамики. В то же время механизм и скорость протекания процессов термодинамикой не рассматриваются, важны только свойства системы в исходном (1) и конечном (2) состояниях. Основана термодинамика на фундаментальных законах природы (постулатах), выведенных логическим путем.
Термодинамика оперирует понятиями со строго определенным смыслом. Так, если выделить из окружающей среды (с помощью реально существующих или воображаемых границ) вещество или совокупность взаимодействующих химических веществ и продуктов их взаимодействия, то вместе с конкретными параметрами в этом пространстве (концентрация веществ, температура, давление) выделенный объем будет называться химической системой. Вещества, образующие данную химическую систему, называются ее химическими компонентами.
Всякое изменение, происходящее в системе, и связанное с ним изменение хотя бы одного из свойств системы, будет называться термодинамическим процессом. Любая термодинамическая величина, которая может характеризовать процесс, называется термодинамическим параметром процесса. Например, при переходе системы из состояния 1 в состояние 2 процесс может быть охарактеризован величиной изменения давления DР = Р2 – Р1, температуры DТ = Т2 – Т1, объема DV = V2 – V1 и т.д.(здесь и далее в тексте знак дельта означает изменение величины ).
|
|
|
Изолированные системы от окружающей среды изолированы полностью, не обмениваются ни веществом, ни энергией. Закрытые от окружающей среды системы не обмениваются с окружающей средой веществом, но возможны другие виды взаимодействия (обмен энергией). В открытых системах может происходить обмен с окружающей средой веществом и энергией (например, живой организм).
Количественный обмен энергией между системой и окружающей средой рассматривается с помощью понятий теплота и работа. Эти понятия применимы только для характеристики протекающих процессов, но не конкретного состояния системы. Теплота и работа являются возможными формами передачи энергии от одной системы к другой, т.е. имеющими место лишь при взаимодействии системы с внешней средой или с другой системой.
Теплота (Q) (или тепловой эффект процесса) – это количественная характеристика энергии, которую система в ходе данного процесса получает (отдает) из окружающей среды. Теплота является формой передачи энергии, реализуемой путем изменения кинетической энергии теплового (хаотического) движения частиц (атомов, молекул и др.). Если процесс сопровождается переходом энергии из окружающей среды к системе, он называется эндотермическим, в обратном направлении – экзотермическим.
Работа (А), совершаемая системой, обусловлена взаимодействием системы с внешней средой, в результате которого преодолеваются внешние силы, нарушившие равновесие в системе. Например, система может отдавать энергию в форме произведенной работы.
Сумма всех видов энергии, присущих данной изолированной системе (включая энергии движения и взаимодействия составляющих систему частиц – молекул, атомов, ядер, электронов), называется внутренней энергией системы(U). Абсолютное значение внутренней энергииопределить невозможно, поэтому для расчетов используется значение изменения DU при переходе системы из одного конкретного состояния в другое. Она характеризует изменения в системе в процессе перехода ее от состояния 1 к состоянию 2 – при постоянном объеме DU = U2 – U1.
В основе термодинамики лежат первый и второй законы термодинамики (или первое и второе начала термодинамики).
Первый закон термодинамики применим к процессам, связанным с превращением теплоты и работы.
В соответствии с первым законом термодинамики (по-другому – законом сохранения энергии), энергия не возникает из ничего и не исчезает бесследно, но энергия одного вида может переходить в энергию другого вида. Отсюда следует, что невозможно создать машину – вечный двигатель первого рода – без сообщения ей энергии.
Энергия, полученная системой в форме теплоты, может превращаться в работу, и наоборот, энергия, полученная в форме работы – в теплоту.
Первый закон термодинамики утверждает, что энергия изолированной системы постоянна. В неизолированной системе энергия может изменяться за счет: а) совершения работы над окружающей средой; б) теплообмена с окружающей средой.
Первый закон термодинамики может быть сформулирован так: в любом процессе приращение внутренней энергии системы DU (в исходном состоянии система обладала внутренней энергией U1, а в конечном U2) равно количеству сообщаемой системе теплоты Q минус количество работы А, совершаемой системой, т.е.
|
|
|
DU = U2 – U1 = Q – A. (2.1)
Изменение внутренней энергии не зависит от пути проведения процесса, а определяется только начальным и конечным состояниями системы. Это означает, что внутренняя энергия является функцией состояния, и ее значение определяется только параметрами данного конкретного состояния, а не путями и самим процессом его достижения. Если система завершила круговой (циклический) процесс и вернулась в исходное состояние, то изменение ее внутренней энергии равно нулю, а значит и сумма балансов теплоты и работы равна нулю. Теплота и работа (имеется в виду любой вид работ: расширение газа, поднятие груза, перенос заряда, изменение поверхностного натяжения и др.), представляющие собой формы передачи энергии, не являются функциями состояния системы, а зависят от пути проведения процесса. По этой причине первый закон записывается в виде дифференциального уравнения:
dU = dQ – dA, (2.2)
где d означает, что dQ и dA не являются полными дифференциалами. Например, для процесса, в котором совершается только механическая работа расширения газа, т.е. dА = P · dV,
dU = dQ – PdV (закрытая система). (2.3)
Для изохорного процесса, т.е. при V = const, откуда dV = 0, следует, что DUV = QV , т.е. вся теплота, подведенная к системе, идет на увеличение U (здесь и далее по тексту нижние индексы V, P или T при параметре означают значение данного параметра соответственно при постоянном объеме, давлении или температуре в системе).
Для изобарного процесса, т.е. когда Р = const, следует:
DUP = QP – P(V2 – V1),
или
QP = U2 – U1 + PV2 – PV1 = (U2 + PV2) – (U1 + PV1). (2.4)
В этом случае не вся теплота, подведенная к системе, идет на увеличение внутренней энергии, часть ее расходуется, например, на работу расширения газа.
В термодинамике для удобства сумма U + PV обозначена буквой Н и названа энтальпией. Тогда можно сказать, что
QP = H2 – H1 = DH, т.е. теплота изобарного процесса равна изменению энтальпии.
Из определения энтальпии также следует, что для процесса при постоянном давлении
Qp = DH = DU + PDV,(2.5)
а при постоянном объеме
QV = DU. (2.6)
Связь Qр и QV.
Qp = QV + DnRT
|
|
|
Энтальпия оказывается весьма удобной для анализа тепловых эффектов химических реакций.
Термохимия. Все химические реакции протекают с выделением или поглощением тепла; изучением тепловых эффектов реакций занимается одним из разделов физической химии – термохимия. Проявление тепловых эффектов при химических реакциях связано с разрывом одних химических связей и возникновением других. Разница в энергиях образующихся связей и тех, которые претерпели разрыв, проявляется в виде результирующего теплового эффекта данного химического процесса. Тепловой эффект реакции обычно относят к 1 моль конечного продукта.
Основой термохимии является закон Гесса: тепловой эффект химической реакции определяется только природой, составом и агрегатным состоянием исходных веществ и продуктов реакции и не зависит от возможных промежуточных химических стадий, т.е. от способа перехода от исходного состояния к конечному (при Р = const или V = const).
Неизвестные тепловые эффекты Qр (где Qp = DH) произвольных химических реакций можно рассчитать при помощи так называемых термохимических уравнений. Последние представляют собой обычные стехиометрические уравнения химических реакций, дополненные указанием агрегатного состояния всех веществ и численным значением теплового эффекта для данной реакции. Термохимическими уравнениями можно оперировать как уравнениями алгебраическими, т.е. складывать их, вычитать, умножать на постоянный множитель и др. Тогда для нахождения неизвестной теплоты какой-либо заданной реакции обычно производят операции комбинирования термохимических уравнений с уравнениями других подходящих реакций, для которых уже известны численные данные по тепловым эффектам (берутся из таблиц). Результатом такой процедуры является получение конечного уравнения искомой реакции с уже найденным (при комбинировании с привлеченными дополнительными уравнениями) численным значением ее теплового эффекта.
Тепловой эффект процесса зависит от температуры. В соответствии с законом Кирхгофа, изменение теплового эффекта с температурой равно разности теплоемкости продуктов реакции и теплоемкости исходных веществ.
Теплоемкостью (Ср) называется отношение количества сообщенной системе теплоты к наблюдаемому при этом повышению температуры. Для нахождения теплового эффекта DH2 при температуре Т2 надо знать DH1 при температуре Т1 и иметь данные по температурной зависимости теплоемкостей веществ, участвующих в реакции, в интервале температур от Т1 до Т2. Последние находятся обычно экспериментальным путем и описываются уравнениями в форме степенного ряда.
Так, если разность теплоемкостей продуктов реакции и исходных веществ 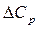 = const, то
= const, то
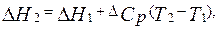 (2.9)
(2.9)
где 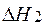 – линейная функция температуры.
– линейная функция температуры.
Второй закон термодинамики. Этот эмпирический закон не имеет единой формулировки, некоторые приведены ниже:
1. Невозможен самопроизвольный (естественный, спонтанный) переход энергии (в форме теплоты) от менее нагретого тела к более нагретому.
Перенос теплоты от холодного тела к горячему связан с компенсацией, т.е. с необходимостью дополнительной затраты работы, которая переходит в конечном счете в теплоту, поглощаемую горячим телом (так, в домашнем холодильнике происходит перенос теплоты от предметов к деталям прибора, а затем и в воздух; этот перенос требует затраты электроэнергии). Процессы, реализация которых связана с компенсацией, называются необратимыми.
2. Невозможно создать вечный двигатель 2-го рода. Тепло океана, например, может быть превращено в работу (согласно первому закону термодинамики), однако только при наличии соответствующего холодильника (согласно второму закону термодинамики).
3. Даже при обратимом течении реакции в работу может перейти только часть теплоты процесса. Другая часть, не превращенная в работу, передается при этом от более нагретых к более холодным частям системы.
Применительно к химическим реакциям (при Р = const, Т = const) этот закон можно выразить математически:
DH = DG + TDS или DG = DH – TDS, (2.10)
где DH2 – тепловой эффект реакции, наблюдаемый при ее необратимом течении;
DG2 – изменение свободной энергии Гиббса, или изменение изобарно-изотермического потенциала, т.е. это та максимальная часть энергии системы, которая в данных условиях может превратиться в полезную работу. При DG < 0 реакция протекает самопроизвольно.
DS – энтропия.Энтропия является функцией каждого конкретного состояния системы и не зависит от пути (например, какие промежуточные стадии проходит система при переходе из состояния 1 в состояние 2 для достижения нового состояния).
Произведением TDS определяется переносимое Q, которое не может быть превращено в работу даже при обратимом ходе реакции (величина «связанной энергии»). Это произведение показывает количество внутренней энергии, теряемой системой в форме теплоты:
TDS = Q или DS = Q / T, (2.11)
где DS = S2 – S1 – изменение энтропии системы при реакции, равное сообщенному системе теплу, деленному на абсолютную температуру, при которой система эту теплоту получает (отдает).
Кроме термодинамического потенциала – свободной энергии Гиббса (G), в термодинамике в качестве вспомогательной функции для описания процессов большое значение имеет и другой введенный термодинамический потенциал – свободная энергия Гельмгольца (F), или изохорно-изотермический потенциал,
DF = DUG – TDS (2.12)
В результате самопроизвольных процессов совершается работа, и когда эта возможность исчерпывается наступает равновесие. Поскольку самопроизвольным процессам соответствуют отрицательные изменения DF и DG, то знак изменения функции G (при P = const, Т = const) или функции F (при V = const, Т = const) и будет показывать возможность или невозможность самопроизвольного протекания реакции. Если изменения этих функций для состояний системы 1 и 2 равны нулю, то система находится в равновесии. Изобарно-изотермический потенциал реакции рассчитывается так же, как и тепловой эффект реакции – по стандартным теплотам образования веществ:
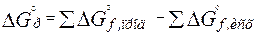 . (2.13)
. (2.13)
Для расчета 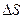 любой реакции надо из суммы энтропий образования продуктов вычесть сумму энтропий образования исходных веществ (с учетом стехиометрических коэффициентов). Так, для стандартных условий:
любой реакции надо из суммы энтропий образования продуктов вычесть сумму энтропий образования исходных веществ (с учетом стехиометрических коэффициентов). Так, для стандартных условий:
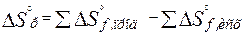 . (2.14)
. (2.14)
4. Самопроизвольно (следовательно, необратимо) в изолированной системе могут протекать только те процессы, которые связаны с увеличением энтропии, т.е. система из менее вероятного состояния переходит в наиболее вероятное и достигает такого макроскопического состояния, которому соответствует наибольшее число микроскопических состояний. Другими словами, процессы бывают самопроизвольными, когда конечное состояние может быть реализовано большим числом микросостояний и энтропия является мерой стремления системы к равновесию. Такие процессы должны сопровождаться увеличением энтропии.
Если для изолированных систем найденное значение DS положительное (DS > 0), то это является признаком самопроизвольности процесса, т.е. осуществление процесса возможно.
При DS < 0 самопроизвольное (без внешних воздействий) осуществление процесса невозможно, т.е. невозможен переход тепла от одного тела к другому телу с более высокой температурой.
Для равновесного процесса DS = 0 энтропия отличается от других параметров состояния системы (Р, Т, V) тем, что ее численное значение и значения ее изменения не поддаются непосредственному измерению и могут быть получены только косвенным, расчетным путем.
Можно сказать (принцип Больцмана), что энтропия – это мера вероятности пребывания системы в данном состоянии, а само содержание второго закона термодинамики обусловлено молекулярной природой и структурой вещества. Поскольку для неупорядоченного состояния термодинамическая вероятность всегда больше, чем для упорядоченного, то и энтропию, связанную с этой вероятностью, часто рассматривают как количественную меру хаотичности атомно-молекулярной структуры вещества. Так, найдено, что значение энтропии увеличивается: с ростом молекулярной массы в ряду веществ-аналогов; при реакциях, протекающих с увеличением числа молекул; при фазовых переходах от твердого к жидкому и от жидкого к газообразному состоянию и др.
Для неизолированной системы критерии возможности протекания процесса остаются теми же, но требуется знание общего изменения энтропии уже для новой термически изолированной системы (т.е. с учетом источника тепла).
Таким образом, критериями возможности самопроизвольного протекания процесса являются:
1. DS > 0 (изолированная система);
2. DF < 0 (V = const, T = const);
3. DG < 0 (Р = const, Т = const).
Если термодинамика дает отрицательный ответ на вопрос о возможности самопроизвольного протекания процесса, это означает, что без внешнего подвода энергии процесс невозможен (например, фотосинтез возможен только под воздействием солнечной энергии).
DG и DH имеют размерность Дж (кДж)/моль (для продуктов питания кДж/кг); DS – Дж/К·моль (энтропийная единица, э.е.); теплоемкость – Дж/К·моль.
Расчет DGо и DНо производится с использованием имеющихся в справочниках значений:
D So298, D Go298 и D Но298 – образования химических соединений.
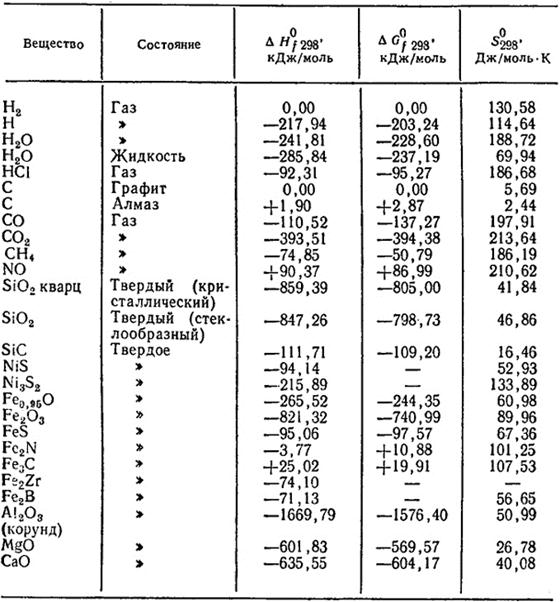
Таблица 1.1. Стандартные термодинамические величины некоторых веществ и энергии связи
 2015-02-18
2015-02-18 10214
10214
