Парообразование - это процесс превращения жидкости в пар путем ее испарения или кипения (при некоторой определенной температуре, называемой температурой насыщения, tн, °С, зависящей от давления). Скорость испарения зависит отприроды жидкости; температуры; площади свободной поверхности; плотности паров жидкости над поверхностью; внешнего давления.
При кипении парообразование происходит как со свободной поверхности, так и во всем объеме жидкости, причем жидкость закипает при такой температуре, при которой давление ее насыщенного пара сравнивается с внешним давлением. Таким образом, температура кипения (насыщения) является функцией давления p, т.е. tн=f(p). При понижении внешнего давления температура кипения уменьшается, а при повышении – увеличивается.
Следовательно, каждому давлению РН соответствует температура насыщения tH. Приближенную зависимость температуры от давления для насыщенного пара в диапазоне температур 90...250° С можно принять по формуле Руша:
tH=100×(P)1/4, (4.1)
где Р - абсолютное давление, кгс/см2.
Вода, закипает при 100 °C если давление составляет 1 атм. При давлении 0,5 атм. вода закипит при 80 °C, а при давлении 2 атм. – при 120 °C, приложение 3.
Основными параметрами фазового перехода из жидкого состояния в газообразное являются: энтальпия; энтропия и внутренняя энергия.
Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергии всегда остается в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Следовательно, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении.
Определить значение энтальпии можно используя первый закон термодинамики согласно которому: количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
H = U + pV. (4.2)
Энтропия – понятие впервые введенное в термодинамике для определения меры необратимого рассеяния энергии и изменение которой для бесконечно малого обратимого изменения состояния системы равно отношению количества теплоты полученного системой в этом процессе (или отнятого от системы), к абсолютной температуре:
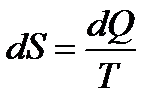 . (4.3)
. (4.3)
То есть показатель энтропиипредставляет собой характеристику термодинамического состояния физической системы.
Внутренняя энергия U определяется как среднее значение суммы всех кинетических энергий хаотического движения молекул или атомов тела и потенциальных энергий взаимодействия всех молекул друг с другом. Изменение внутренней энергии можно определить из первого закона термодинамики:
ΔU=σQ-σA. (4.4)
Все параметры кипящей жидкости обозначаются с одним штрихом: q′, V′, S′, U′, H ′.
Все параметры сухого насыщенного пара обозначаются с двумя штрихами: q", V", S", U", H ".
Если плотность пара над поверхностью жидкости велика, то конденсация может происходить с той же скоростью, что и испарение, т.е. число молекул, покидающих жидкость в единицу времени, равно числу молекул, возвращающихся в нее, такой пар называется влажным насыщенным.
Если при постоянном давлении к кипящей жидкости подвести необходимое количество теплоты для полного превращения жидкости в пар, то в момент исчезновения полезных капель, получим сухой насыщенный пар при температуре Т.
Если при постоянном давлении подводить тепло к сухому насыщенному пару его температура будет возрастать, а удельный объем— увеличиваться. Пар, температура которого выше температуры кипения, соответствующей его давлению, называют перегретым паром.
 2015-03-22
2015-03-22 1242
1242
