Удельная теплоемкость вещества c – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
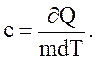 (2.40)
(2.40)
Единица удельной теплоемкости – Дж/(кг×К).
Молярная теплоемкость Cm - величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
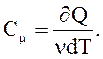 (2.41)
(2.41)
Единица удельной теплоемкости – Дж/(моль×К).
Связь между Cm и c:
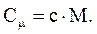
Различают теплоемкости (удельную и молярную) при постоянном объеме (сV и CmV) и при постоянном давлении (cP и CmP), если в процессе нагревания вещества его объем или давление поддерживаются постоянными.
1. Молярная теплоемкость при постоянном объеме
Из первого начала термодинамики 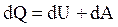 с учетом
с учетом 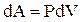 и
и 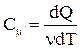 для 1 моль газа получим:
для 1 моль газа получим:
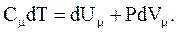
При 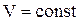 работа внешних сил
работа внешних сил 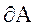 равна нулю и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии. Тогда
равна нулю и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии. Тогда
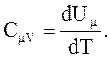
CmV равна изменению внутренней энергии 1 моль газа при повышении его температуры на 1 К.
Поскольку 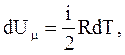 то
то
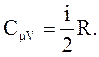 (2.42)
(2.42)
2. Молярная теплоемкость при постоянном давлении. Уравнение Майера
Если газ нагревается при 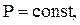 то
то
|
|
|
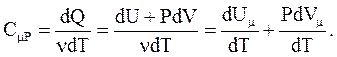
Слагаемое 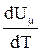 не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от P, ни от V, а определяется только T) и всегда равно CmV. Согласно уравнению Менделеева-Клапейрона
не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от P, ни от V, а определяется только T) и всегда равно CmV. Согласно уравнению Менделеева-Клапейрона 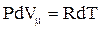 , тогда
, тогда
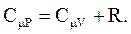 (2.43)
(2.43)
Выражение (2.43) – уравнение Майера.
СmP всегда больше CmV на величину универсальной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа.
Тогда
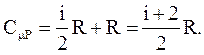 (2.44)
(2.44)
При рассмотрении термодинамических процессов важную роль играет величина
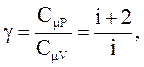 (2.45)
(2.45)
которая называется коэффициентом Пуассона.
 2015-03-27
2015-03-27 469
469








