Пример 1. Вычислить электродвижущую силу (ЭДС) окислительно-восстановительного гальванического элемента, состоящего из медного и оловянного электродов, опущенных в 0,2 М раствор нитрата меди и 0,05 М раствор нитрата олова. Составить схему цепи и написать реакцию, протекающую в гальваническом элемента.
Таблица. 1 Значение нормальных электродных потенциалов при 250 С
| Электрод | Нормальный электродный потенциал, Е0 В |
| Ag/Ag+ | +0,799 |
| Cu/Cu2+ | +0,344 |
| Ag/AgCl тв., Cl- | +0,222 |
| Sb/Sb3+ | +0,200 |
| H2, (Pt)/H+ | |
| Pb/Pb2+ | -0,127 |
| Sn/Sn2+ | -0,140 |
| Ag/AgI тв., I- | -0,152 |
| Ni/Ni2+ | -0,230 |
| Co/Co2+ | -0,270 |
| Cd/Cd2+ | -0,400 |
| Fe/Fe2+ | -0,440 |
| Zn/Zn2+ | -0,760 |
| Mn/Mn2+ | -1,18 |
Из табл. 1 находим стандартные электродные потенциалы меди и олова: 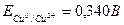 и
и 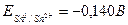 . Пишем схему гальванического элемента:
. Пишем схему гальванического элемента:
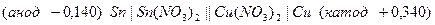
Далее составляем электродные процессы протекающие на катоде и аноде:
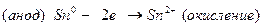
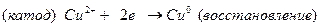
По формуле Нернста определяем электродные потенциалы свинца и меди:
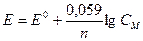
где; 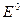 - нормальный потенциал металла, В,
- нормальный потенциал металла, В, 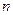 - число принятых или отданных электронов,
- число принятых или отданных электронов, 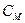 - молярная концентрация, моль/л.
- молярная концентрация, моль/л.
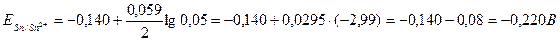
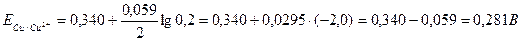
Вычисляем ЭДС гальванического элемента;
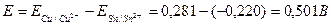
Пример 2. Измерения рН раствора проводилось с помощью хингидронного электрода. Рассчитайте рН раствора, если ЭДС элемента 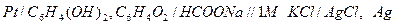 при 250С равна 0,006 В. Стандартный электродный потенциал хингидронного электрода (х.г.э) равен 0,699 В; потенциал хлорсеребярнного электрода (х.с.э.) составляет 0,222 В при 250С.
при 250С равна 0,006 В. Стандартный электродный потенциал хингидронного электрода (х.г.э) равен 0,699 В; потенциал хлорсеребярнного электрода (х.с.э.) составляет 0,222 В при 250С.
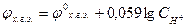
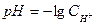
Следовательно 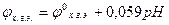
ЭДС элемента равна 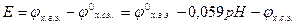
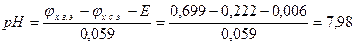
Пример 3. В стандартных растворах NaF были измерены электродные потенциалы фторидселективного электрода относительно хлорсеребряного электрода и получены следующие данные:
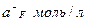
| 1∙10-1 | 1∙10-2 | 1∙10-3 | 1∙10-4 | 1∙10-5 |
| Е, мВ |
Исследуемый образец воды, содержащий фторид-ион, объемом 10,00 мл разбавили водой до 50,00 мл и измерили электродный потенциал фторидселективного электрода в полученном растворе: Ех=210 мВ. Определить концентрацию фторид-иона в исследуемом растворе.
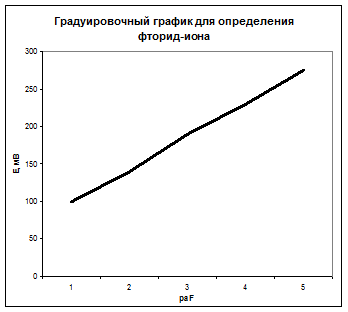
Строим градуировочный график в координатах 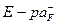 , где
, где 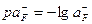 . По графику рис. 1 находим
. По графику рис. 1 находим 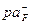 =3,5 и
=3,5 и 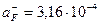 моль/л, соответствующую Ех=210 мВ, и рассчитываем активность исследуемого раствора:
моль/л, соответствующую Ех=210 мВ, и рассчитываем активность исследуемого раствора:
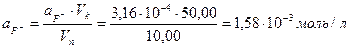
Задачи
Задача 1. Составить схему гальванического элемента. Написать протекающие на электродах реакции и рассчитать ЭДС гальванического элемента.
| № | МеI | МеII | CM(I) (моль/л) | CM(II) (моль/л) |
| Ag | Cu | 0,02 | 0,015 | |
| Cu | Sb | 0,1 | 0,05 | |
| Sb | Pb | 0,05 | 0,02 | |
| Pb | Sn | 0,01 | 0,001 | |
| Ni | Cu | 0,2 | 0,001 | |
| Co | Cd | 0,25 | 0,002 | |
| Cd | Co | 0,001 | 0,01 | |
| Fe | Zn | 0,002 | 0,015 | |
| Zn | Fe | 0,02 | 0,05 | |
| Ag | Sb | 0,1 | 0,02 | |
| Cu | Pb | 0,05 | 0,1 | |
| Sb | Sn | 0,01 | 0,001 | |
| Pb | Ni | 0,2 | 0,002 | |
| Ni | Cd | 0,25 | 0,01 | |
| Co | Mn | 0,001 | 0,015 | |
| Cd | Zn | 0,002 | 0,05 | |
| Fe | Cu | 0,02 | 0,01 | |
| Zn | Mn | 0,1 | 0,01 | |
| Ag | Pb | 0,05 | 0,001 | |
| Cu | Sn | 0,01 | 0,002 | |
| Sb | Ni | 0,2 | 0,01 | |
| Pb | Cd | 0,25 | 0,015 | |
| Ni | Co | 0,01 | 0,05 | |
| Co | Zn | 0,002 | 0,02 | |
| Cd | Fe | 0,02 | 0,1 |
Задача 2. ЭДС цепи (или рН), составленной из электродов составляет (см. свой вариант), определите рН или ЭДС цепи исследуемого раствора (Х – искомая величина).
| № | ЭДС цепи | Электрод (1) | Электрод (2) | Е0 (1) | Е0 (2) | рН |
| Х при 250 | 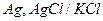 хлорсеребрянный хлорсеребрянный
| 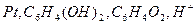 хингидронный хингидронный
| 0,226 | 0,699 | 3,37 | |
| 0,224 при 300 | 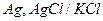 хлорсеребрянный хлорсеребрянный
| 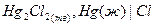 каломельный каломельный
| 0,226 | 0,420 | Х | |
| 0,154 при 250 | 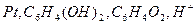 хингидронный хингидронный
| 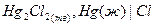 каломельный каломельный
| 0,699 | 0,420 | Х | |
| 0,105 при 200 | 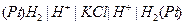 водородный
водородный
| 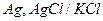 хлорсеребрянный хлорсеребрянный
| 0,226 | Х | ||
| Х при 250 | 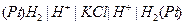 водородный
водородный
| 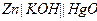 окисно-ртутный
окисно-ртутный
| 1,340 | 11,89 | ||
| 0,248 при 200 | 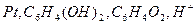 хингидронный хингидронный
| 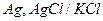 хлорсеребрянный хлорсеребрянный
| 0,699 | 0,226 | Х | |
| 0,127 при 250 | 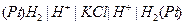 водородный
водородный
| 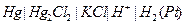 каломельный насыщенный
каломельный насыщенный
| 0,250 | Х | ||
| Х при 400 | 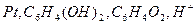 хингидронный хингидронный
| 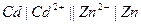 кадмиево-цинковый
кадмиево-цинковый
| 0,699 | 0,360 | 2,27 | |
| 0,102 при 180 | 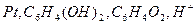 хингидронный хингидронный
| 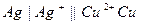 серебрено-медный
серебрено-медный
| 0,699 | 0,459 | Х | |
| Х при 250 | 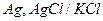 хлорсеребрянный хлорсеребрянный
| 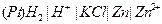 водородно-цинковый
водородно-цинковый
| 0,226 | 0,760 | 4,00 | |
| Х при 250 | 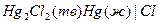 каломельный каломельный
| 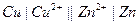 медно-цинковый
медно-цинковый
| 0,420 | 1,100 | 5,80 | |
| 0,205 при 250 | 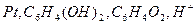 хингидронный хингидронный
| 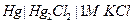 нормальный каломельный
нормальный каломельный
| 0,699 | 0,280 | Х | |
| 0,310 при 250 | 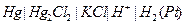 каломельный насыщенный
каломельный насыщенный
| 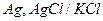 хлорсеребрянный хлорсеребрянный
| 0,624 | 0,201 | Х | |
| Х при 250 | 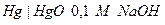 оксидно-ртутный оксидно-ртутный
| 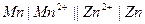 марганцево-цинковый
марганцево-цинковый
| 0,926 | 0,420 | 4,76 | |
| 0,110 при 250 | 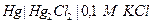 каломельный
каломельный
| 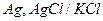 хлорсеребрянный хлорсеребрянный
| 0,527 | 0,234 | Х | |
| Х при 250 | 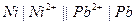 никелево-свинцовый
никелево-свинцовый
| 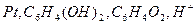 хингидронный хингидронный
| 0,103 | 0,699 | 6,29 | |
| Х при 250 | 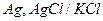 хлорсеребрянный хлорсеребрянный
| 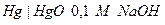 оксидно-ртутный оксидно-ртутный
| 0,201 | 0,926 | 6,36 | |
| 0,208 при 250 | 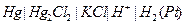 каломельный насыщенный
каломельный насыщенный
| 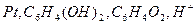 хингидронный хингидронный
| 0,250 | 0,699 | Х | |
| Х при 250 | 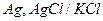 хлорсеребрянный хлорсеребрянный
| 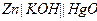 окисно-ртутный
окисно-ртутный
| 0,226 | 1,340 | 9,13 | |
| 0,150 при 250 | 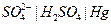 ртутно-сульфатный
ртутно-сульфатный
| 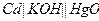 ртутно-кадмиевый
ртутно-кадмиевый
| 0,615 | 1,018 | Х | |
| 0,040 при 250 | 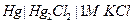 нормальный каломельный
нормальный каломельный
| 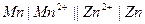 марганцево-цинковый
марганцево-цинковый
| 0,280 | 0,420 | Х | |
| Х при 250 | 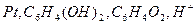 хингидронный хингидронный
| 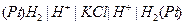 водородный
водородный
| 0,699 | 0,000 | 7,64 | |
| Х при 250 | 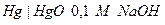 оксидно-ртутный оксидно-ртутный
| 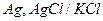 хлорсеребрянный хлорсеребрянный
| 0,926 | 0,201 | 7,62 | |
| 0,160 при 250 | 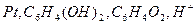 хингидронный хингидронный
| 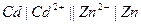 кадмиево-цинковый
кадмиево-цинковый
| 0,699 | 0,360 | Х | |
| Х при 250 | 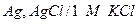 хлорсеребрянный хлорсеребрянный
| 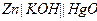 окисно-ртутный
окисно-ртутный
| 0,234 | 1,340 | 13,23 |
Задача 3а. В стандартных растворах веществ с различной активностью металлов измерены электродные потенциалы ионоселективными электродами относительно хлорсеребряного электрода и получены следующие данные (по этим данным построить калибровочный график и определить активность (моль/л) исследуемого раствора);
| № | Станд. р-р | Меn+ | Данные | |||||
| CdSO4 | Cd2+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 75,0 | 100,0 | 122,0 | 146,0 | 170,0 | |||
| K2SO4 | K+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | - | |
| -Е, мВ | 100,0 | 46,0 | −7,00 | −60,0 | - | |||
| CaCl2 | Ca2+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | - | |
| -Е, мВ | 45,0 | 12,0 | - 15,0 | - 35,0 | - | |||
| MgCl2 | Mg2+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | - | |
| -Е, мВ | 78,0 | 56,0 | 26,0 | 5,0 | - | |||
| CuSO4 | Cu2+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 82,0 | 110,0 | 132,0 | 159,0 | 192,0 | |||
| KNO3 | NO3- | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 25,0 | 56,0 | 84,0 | 123,0 | 162,0 | |||
| KCl | Cl- | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 5,0 | -23,0 | -65,0 | -120,0 | -165,0 | |||
| Pb(NO3)2 | Pb2+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 70,0 | 95,0 | 117,0 | 139,0 | 165,0 | |||
| NH4SCN | SCN- | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 80,0 | 105,0 | 127,0 | 149,0 | 175,0 | |||
| Na3PO4 | PO43- | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 95,0 | 120,0 | 142,0 | 164,0 | 200,0 | |||
| CdSO4 | Cd2+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 75,0 | 100,0 | 122,0 | 146,0 | 170,0 | |||
| NaCl | Na+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 85,0 | 110,0 | 132,0 | 154,0 | 190,0 | |||
| NH4Cl | NH+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | -15,0 | -60,0 | -102,0 | -134,0 | -170,0 | |||
| Li2SO4 | Li+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 65,0 | 90,0 | 112,0 | 134,0 | 170,0 | |||
| FeCl2 | Fe2+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 15,0 | 60,0 | 102,0 | 134,0 | 170,0 | |||
| CdSO4 | Cd2+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 75,0 | 100,0 | 122,0 | 146,0 | 170,0 | |||
| BaCl2 | Ba2+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 80,0 | 26,0 | -10,0 | -50,0 | -90,0 | |||
| AgNO3 | Ag+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 5,0 | 10,0 | 22,0 | 46,0 | 70,0 | |||
| TlCl | Tl+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 15,0 | 68,0 | 89,0 | 146,0 | 190,0 | |||
| CdSO4 | Cd2+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 75,0 | 100,0 | 122,0 | 146,0 | 170,0 | |||
| Hg2Cl2 | Hg2+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 89,0 | 134,0 | 168,0 | 201,0 | 265,0 | |||
| FeCl3 | Fe3+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 25,0 | 65,0 | 107,0 | 139,0 | 175,0 | |||
| K2Cr2O7 | Cr6+ | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | -95,0 | -20,0 | 85,0 | 139,0 | 175,0 | |||
| Na2S | S2- | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 23,0 | 57,0 | 85,0 | 139,0 | 170,0 | |||
| KI | I- | аМе, моль/л | 1,0∙10-1 | 1,0∙10-2 | 1,0∙10-3 | 1,0∙10-4 | 1,0∙10-5 | |
| -Е, мВ | 7,0 | 65,0 | 111,0 | 152,0 | 186,0 |
Задача 3б. Потенциал ионоселективного электрода в исследуемом растворе соли объемом (V1), разбавленном до (V2) составил E, мВ. Определить содержание металла в растворе (ответ выразить в моль/л и в г/л).
| № | Соль | Меn+ | Потенциал, Е, мВ | V1, мл | V2, мл |
| CdSO4 | Cd2+ | 94,0 | 10,0 | 50,0 | |
| K2SO4 | K+ | 10,0 | 50,0 | 100,0 | |
| CaCl2 | Ca2+ | 12,0 | 25,0 | 50,0 | |
| MgCl2 | Mg2+ | 44,0 | 20,0 | 100,0 | |
| CuSO4 | Cu2+ | 94,0 | 25,0 | 100,0 | |
| KNO3 | NO32- | 91,0 | 50,0 | 100,0 | |
| KCl | Cl- | -73,0 | 50,0 | 100,0 | |
| Pb(NO3)2 | Pb2+ | 108,0 | 25,0 | 100,0 | |
| NH4SCN | SCN- | 117,0 | 10,0 | 50,0 | |
| Na3PO4 | PO43- | 181,0 | 15,0 | 50,0 | |
| CdSO4 | Cd2+ | 116,0 | 10,0 | 100,0 | |
| NaCl | Na+ | 91,0 | 25,0 | 200,0 | |
| NH4Cl | NH4+ | -102,0 | 10,0 | 50,0 | |
| Li2SO4 | Li+ | 156,0 | 50,0 | 250,0 | |
| FeCl2 | Fe2+ | 108,0 | 25,0 | 50,0 | |
| CdSO4 | Cd2+ | 130,0 | 10,0 | 50,0 | |
| BaCl2 | Ba2+ | -36,0 | 50,0 | 100,0 | |
| AgNO3 | Ag+ | 49,0 | 25,0 | 100,0 | |
| TlCl | Tl+ | 178,0 | 10,0 | 100,0 | |
| CdSO4 | Cd2+ | 102,0 | 50,0 | 100,0 | |
| Hg2Cl2 | Hg2+ | 222,0 | 25,0 | 50,0 | |
| FeCl3 | Fe3+ | 161,0 | 50,0 | 100,0 | |
| K2Cr2O7 | Cr6+ | 155,0 | 50,0 | 50,0 | |
| Na2S | S2- | 98,0 | 25,0 | 50,0 | |
| KI | I- | 114,0 | 50,0 | 100,0 |
 2015-03-27
2015-03-27 963
963








