ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА ВОДЫ И ВОДЯНОГО ПАРА
Под термином "вода" будем понимать Н2О в любом из возможных ее фазовых состояний.
В природе вода м.б. в трех состояниях: тв.(лед, снег), ж. (вода), г.(пар).
Рассм-м воду без энергетич. взаимодействия с окр. ср., т.е. в равновесном состоянии.
У поверхности льда или жидкости всегда присутствует пар. Соприкасающиеся фазы находятся в т/д равновесии: быстрые мол-лы вылетают из жидкой фазы, преодолевая поверхностные силы, а из паровой фазы медленные молекулы переходят в ж. фазу.
В состоянии равновесия каждой Т соответствует определенное давление пара – полное (если над жидкостью присутствует только пар) или парциальное (если присутствует смесь пара с воздухом или другими газами).
Пар, находящийся в равновесном состоянии с ж. фазой, из которой он образовался - насыщенный, а соответствующая ему Т - Т насыщения, а давление – р насыщения.
Неравновесные состояния воды:
а) Пусть понижается давление пара над жидкостью ниже давления насыщения. В этом случае нарушается равновесие, происходит некомпенсированный переход вещества из жидкой фазы в газообразную через поверхность раздела фаз за счет наиболее быстрых молекул.
Процесс некомпенсированного перехода вещества из ж. фазы в г. - испарение.
Процесс некомпенсированного перехода вещества из твердой фазы в газовую называется сублимацией или возгонкой.
Интенсивность испарения или сублимации возрастает при интенсивном отводе образующегося пара. При этом понижается температура жидкой фазы за счет вылета из нее молекул с наибольшей энергией. Этого можно добиться и без понижения давления, просто обдувом потока воздуха.
б) Пусть идет подвод теплоты к жидкости, находящейся в открытом сосуде. При этом Т, а соответственно и р насыщенного пара над жидкостью растет и может достигнуть полного внешнего давления (Р=Рн).В случае, когда Р=Рн, у поверхности нагрева Т жидкости поднимается выше Т насыщенного пара при господствующем здесь давлении, т.е. создаются условия образования пара в толще жидкости.
Процесс перехода вещества из жидкой фазы в паровую непосредственно внутри жидкости называется кипением.
Процесс зарождения пузырьков пара в толще жидкости сложен. Для кипения воды необходимо наличие центров парообразования на поверхности подвода теплоты – углубления, выступы, неровности и т.п. У поверхности нагрева, при кипении, разность Т воды и насыщенного пара при господствующем здесь давлении зависит от интенсивности подвода теплоты и может достигать десятков градусов.
Действие сил поверхностного натяжения жидкости обусловливает перегрев жидкости на поверхности раздела фаз при ее кипении на 0,3-1,5 оС по отношению к температуре насыщенного пара над ней.
Любой процесс перехода вещества из жидкой фазы в паровую - парообразование.
Процесс, противоположный парообразованию, т.е. некомпенсированный переход вещества из паровой фазы в жидкую - конденсация.
При постоянном давлении пара конденсация происходит (как и кипение) при постоянной температуре и является результатом отвода теплоты от системы.
Процесс, противоположный сублимации, т.е. переход вещества из паровой фазы непосредственно в твердую - десублимация.
Жидкая фаза воды при температуре кипения называется насыщенной жидкостью.
Пар при температуре кипения (насыщения) называется сухим насыщенным паром.
Двухфазная смесь "ж+п" в состоянии насыщения - влажный насыщенный пар.
В т/д этот термин распространяется на двухфазные системы, в которых насыщенный пар может находиться над уровнем жидкости или представлять смесь пара с взвешенными в нем капельками жидкости.Для характеристики влажного насыщенного пара используется понятие степени сухости х, представляющее собой отношение массы сухого насыщенного пара,mс.н.п, к общей массе смеси,mсм = mс.н.п+ mж.с.н, его с жидкостью в состоянии насыщения:
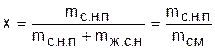 . (1)
. (1)
Отношение массы жидкой фазы воды в состоянии насыщения к массе смеси называется степень влажности (1-х):
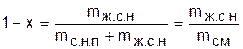 . (2)
. (2)
Подвод теплоты к влажному насыщенному пару при постоянном р приводит к переходу ж. фазы смеси в п. При этом Т смеси (насыщения) не м.б. повышена до тех пор, пока вся жидкость не будет превращена в пар. Дальнейший подвод теплоты только к паровой фазе в состоянии насыщения приводит к повышению Т пара.
Пар с температурой выше температуры насыщения при данном давлении называется перегретым паром. Разность температур перегретого пара t и насыщенного пара того же давления tн называется степенью перегрева пара Dtп = t -tн.
С увеличением степени перегрева пара его объем растет, концентрация молекул уменьшается, по своим свойствам он приближается к газам.
6.2. Фазовые диаграммы Р,t-, Р,v- и T,s для Н2О
Для анализа различных т/д процессов изменения состояния H2O широкое применение находят фазовые диаграммы.
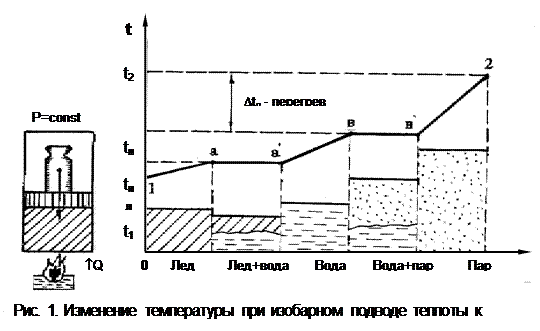 |
Представим, что в цилиндре под поршнем, создающим постоянное р (рис.1), находится лед при начальной Т t1. Ч/з стенки цилиндра подводится теплота Q, процесс нагрева и фазовых переходов H2О показан в t,Q- диаграмме. Лед нагревается до Т плавления tпл (пр-с 1а), после чего лед плавится при постоянной Т и превращается в воду (аа'), далее вода нагревается до Т кипения (насыщения) tн (a'в), затем идет процесс испарения и превращения воды в сухой насыщ. пар (вв'), далее идет процесс перегрева пара (в'2) до Т t2.
Тот же процесс (12) получения перегретого пара из льда при постоянном давлении представлен на рис. 2 в системе Р,t. Т. к. процессы плавления (aa') и парообразования (вв') протекают при постоянной Т, на рис. 2 они концентрируются в точки а и в. В Р,t- диаграмме эти точки характеризуют термодинамическое равновесие двухфазных смесей. Геометрически место этих точек при различных давлениях и соответствующих им температурах представляет собой линии фазовых переходов.
АВ – линия фазового перехода твердой и жидкой фаз. Это аномальная линия, т.к. для большинства веществ с ростом давления растет и Т плавления, для воды наоборот.
АК – линия фазового перехода жидкой и паровой фаз, с повышением давления растет и Т кипения (насыщения) воды и пара.
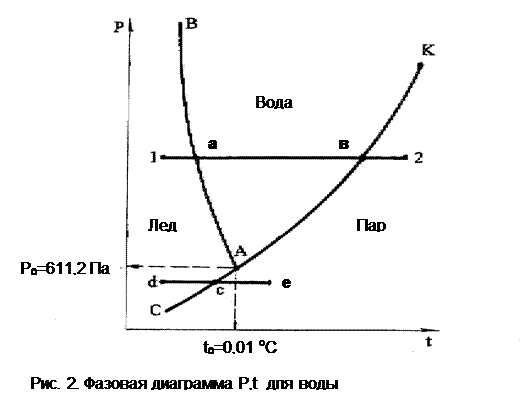 |
С понижением р разность температур плавления и насыщения уменьшается, и в точке А указанные кривые сходятся. Эта точка А называется тройной точкой воды; ее координаты определяют физические условия (Ро иtо), при которых все три фазы вещества находятся в термодинамическом равновесии и могут существовать одновременно. Параметры тройной точки воды:tо = 0,01 оС или 273,16 К и Ро=611,2 Па.
АС, ниже тройной точки, – линия фазового перехода и равновесия тв. и п. фаз, т.е. линия сублимации и десублимации. Так, при р, соответствующем процессу de, при нагреве твердой фазы (de) в точке с происходит переход твердой фазы в пар – сублимация, при охлаждении (еd) в точке c происходит переход пара в тв. фазу – десублимация. В обоих случаях переход минует жидкую фазу.
Кривыми фазовых переходов все поле Р,t- диаграммы делится на три зоны:
левее ВАС – зона твердого состояния (лед),
между ВА и КА – зона жидкости,
правее КАС – зона перегретого пара.
При этом линия АК вверху заканчивается точкой К, определяемой критическими параметрами. При давлениях выше критического видимого фазового перехода жидкости в пар нет.
Вода относится к веществам, имеющим несколько модификаций кристаллических фаз. В настоящее время известно 6 модификаций водяного льда. При давлениях, достигаемых в обычных технических устройствах, получается только одна модификация льда. Все остальные модификации могут быть получены при высоких давлениях.
Для веществ с нормальной закономерностью изменения объема (к ним относятся большинство веществ, встречающихся в природе, но вода к ним не относится) при постоянном давлении с увеличением температуры объем непрерывно увеличивается. У таких веществ при Р=const объем твердой фазы меньше объема жидкости, а объем жидкости меньше объема пара.
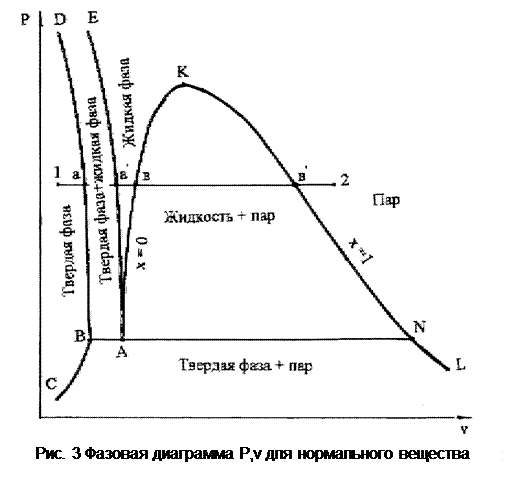 |
В соответствии с этой закономерностью можно построить фазовую диаграмму Р,v для нормального вещества (рис.3).
DС – твердая фаза при температуре плавления; АЕ – жидкость при температуре плавления; АК – жидкость при температуре насыщения (кипения, x=0); КL – сухой насыщенный пар (x=1), ВС – твердая фаза при температуре сублимации.
Левее линии СВD – область твердого состояния; между линиями ВД и АЕ – твердая фаза + жидкость; между линиями АЕ и АК – область жидкости; между линиями АК и КN – жидкость + пар; между линиями СВ, ВN и NL – твердая фаза + пар; правее линии КL – область паровой фазы. Горизонталь ВАN соответствует тройной точке нормального вещества в Р,t- диаграмме.
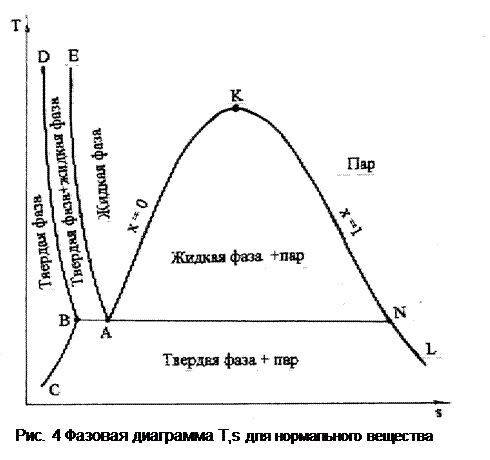 |
Аналогично диаграмме Р,v выглядит фазовая диаграмма T,s для нормального вещества (рис.4). Здесь левее линии DВС – твердая фаза, между линиями ВD и АЕ – двухфазное состояние, твердая фаза+жидкость, между АЕ и АК – жидкая фаза, между ВС и NL – двухфазное состояние, твердая фаза+пар; правее линии КL – перегретый пар; между АК и КN – двухфазное состояние жидкость+пар в состоянии насыщения (влажный насыщенный пар).
Эти фазовые диаграммы не могут быть распространены целиком на воду. Вода – аномальное вещество, при изобарном переходе ее из жидкого состояния в твердое удельный объем воды увеличивается (лед плавает на поверхности воды). Поэтому в Р,v- диаграмме область двухфазного состояния лед+жидкость частично накладывается на зону влажного пара и жидкости.

В результате фазовая диаграмма Р,v для воды имеет вид, представленный на рис. 5, а. Здесь левее линии СВD находится твердая фаза воды, левее линии АК – жидкая фаза воды, между линиями ЕАВD – двухфазное состояние жидкость+лед, между линиями СВNL – двухфазное состояние лед+пар, выше линии КL – перегретый пар. Благодаря аномальным свойствам воды происходит наложение областей различных фазовых состояний воды в Р,v- диаграмме: область двухфазного состояния лед+жидкость ЕАВD накладывается на область жидкости ЕАМD и на область двухфазного состояния жидкость+пар АМВА, кроме этого идет наложение и на область твердой фазы левее линии ВD. Необходимо отметить, что изображение этих областей на рис. 6.7, а выполнено для большей наглядности укрупнено, без соблюдения масштаба. В действительности объемы жидкости и льда намного меньше, чем в точках А и В, в то же время с уменьшением температуры и увеличением давления происходит уменьшение объемов этих фазовых состояний, т.е. левее линии АЕ область жидкости увеличивается по мере возрастания давления, а твердая фаза, находясь левее линии АЕ, не может располагаться левее области жидкой фазы воды при отрицательных температурах.
Для иллюстрации наложения друг на друга различных фаз воды в Р,v- диаграмме на рис. 5, а, б изображены две изотермы (пунктирные линии), имеющие температуру больше (t>tо) и меньше (t<tо) температуры тройной точки воды tо.
Изотерма 1234 имеет температуру меньше 0 оС и проходит в Р,v- диаграмме на линии 12 в области жидкости, на линии 22' – в области двухфазного состояния жидкость+лед, на линии 2'3 – в области льда, на линии 33' – в области двухфазного состояния лед+пар, на линии 3'4 – в области перегретого пара.
Изотерма 567 имеет температуру больше 0 оС и проходит в Р,v- диаграмме на линии 56 в области жидкости, на линии 66' – в области двухфазного состояния жидкость+пар, на линии 6'7 – в области перегретого пара.
Точки пересечения этих изотерм в Р,v- диаграмме свидетельствуют о наложении различных фазовых состояний воды друг на друга. В данных точках эти фазовые состояния имеют одинаковые удельные объемы при одинаковых значениях давлений и различных значениях температур. Так жидкость на изотерме 56 имеет одинаковый удельный объем с жидкостью+лед с одной из точек на изотерме 22', а лед на изотерме 2'3 имеет одинаковый объем с жидкостью+пар с одной из точек на изотерме 66'.
При построении фазовой T,s- диаграммы воды начало отсчета энтропии выбирают при параметрах тройной точки воды (tо=0,01 оС и Ро=611,2 Па) для жидкости в состоянии насыщения (х=0).
В дальнейшем ввиду малого отличия температуры тройной точки воды от 0 оС будет использоваться в основном значение нуля градусов Цельсия (под ним подразумевается температура тройной точки воды).
 2015-03-08
2015-03-08 10319
10319