Задача 1. Как и большинство протеолитических ферментов, трипсин обладает специфичностью действия - этот фермент активен в отношении пептидных связей, образованных карбоксильной группой аргинина и лизина. Молекулы трипсина не атакуют друг друга, т.к. аминокислотные последовательности на поверхности молекулы трипсина не соответствуют его специфичности.
Задача 2. Согласно теории индуцированного соответствия (теории Кошленда), связываясь с активным центром, субстрат вызывает изменение пространственной формы молекулы фермента и переводит его в более устойчивую, стабильную конформацию.
Задача 3. Наличие сильного положительного заряда, большое число свободных орбиталей (следовательно, способность связывать большое число лигандов обусловливают их участие в биокатализе в качестве кофакторов.
Задача 4:
а) ДФФ относится к специфическим необратимым ингибиторам «сериновых» ферментов, т.к. он образует ковалентную связь с гидроксильной группой серина в активном центре фермента при условии определенного окружения радикала серина – Асп, Сер, Глу. Вывод, сделанный студентом, о наличии в активном центре ферментов Е1 и Е2 серина, правильный.
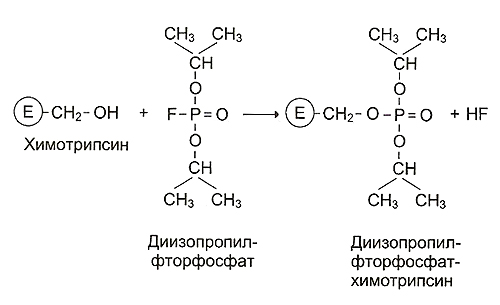
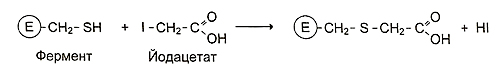
Использовать монойодуксусную кислоту для установления структуры функциональных групп активного центра фермента нельзя. Это вещество относится к необратимым неспецифическим ингибиторам ферментов и образует ковалентные связи со свободными SH-группами цистеина, занимающими любое положение в молекуле белков. Вывод студента о наличии SH-группы в активном центре ферментов Е1, Е2 и Е3 необходимо проверить, применяя специфические ингибиторы;
б) Добавляя субстрат в реакционную смесь, уже содержащую фермент и ДФФ или монойодуксусную кислоту, он смог оценить ингибирующее действие этих веществ по снижению скорости расходования субстрата или образования продукта. Результаты опытов показали снижение активности всех ферментов (Е1, Е2, Е3).
Удельная активность фермента = S (мкмоль) /τ (мин) · m (мг).
 2015-03-08
2015-03-08 2127
2127
