Энтропия - это термодинамическая функция состояния системы, которая отражает вероятность реализации того или иного состояния системы в процессе теплообмена.
Энтропия – это мера неупорядоченности состояния системы; стремление частиц (молекул, ионов, атомов) к хаотическому движению. По изменению энтропии в ходе реакции можно судить о переходе системы от более упорядоченного состояния к менее упорядоченному или наоборот.
Энтропия возрастает (∆Ѕ>0) с увеличением движения частиц при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п.
Процессы, связанные с упорядоченностью системы (конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация), сопровождаются уменьшением энтропии (∆Ѕ < 0). Измеряется энтропия в Дж/(моль×К).
Изменение энтропии системы в результате протекания химической реакции (∆S) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов. Изменение энтропии в результате протекания химической реакции
aA + bB = сС + dD:
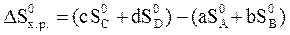 .
.
Энтропия также является одним из критериев возможности самопроизвольного протекания процесса: в изолированной системе самопроизвольно могут протекать только такие процессы, которые ведут к увеличению неупорядоченности системы, т.е. к росту энтропии.
 2015-04-12
2015-04-12 6689
6689
