| За нуль принят потенциал стандартного водородного электрода. Такой электрод состоит из платинированной платины, контактирующей с газообразным водородом, находящимся под давлением 100 кПа (р=1), и раствором, в котором активность ионов Н+ равна единице. Водородный электрод относится к газовым электродам, т.е. электродам, в которых, по крайней мере, одни из реагентов является газообразным. Так как для протекания электродной реакции необходим подвод и отвод электронов, то газовые электроды содержат проводники 1-го рода, которые непосредственно в реакции не участвуют (их ионы не переходят в раствор) и в ходе реакции не меняются. В качестве проводника 1-го рода для стандартного водородного электрода служит платина. При контакте платины с молекулярным водородом происходит адсорбция водорода на платине. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в платине электроны. При этом платина заряжается отрицательно, а раствор – положительно. Возникает скачок потенциала между платиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода. Равновесие на водородном электроде можно представить в виде 2Н+ + 2е ↔ Н2 Абсолютное значение потенциала водородного электрода неизвестно, но условно его считают за нуль. |
Водородная шкала потенциалов Для определения потенциалов электродов по водородной шкале собирают гальванический элемент, одним из электродов которого является измеряемый, а вторым – стандартный водородный электрод. Схему такого элемента записывают следующим образом: слева – водородный электрод, справа – измеряемый электрод. Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид: Н2, Pt|H+l||Zn2+|Zn а схема элемента для измерения потенциала медного электрода: H2, Pt |H+1||Cu2+ | Cu 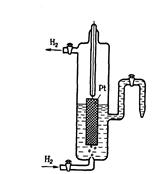 Схема водородного электрода ЭДС элемента равна разности потенциалов правого и левого электродов. А так как потенциал левого электрода условно принимается равным нулю, то ЭДС измеряемого элемента будет равна потенциалу) правого электрода. Таким образом, электродный потенциал по водородной шкале Е – это ЭДС электрохимической системы, в которой справа расположен данный электрод, а слева – стандартный водородный электрод. Схема водородного электрода ЭДС элемента равна разности потенциалов правого и левого электродов. А так как потенциал левого электрода условно принимается равным нулю, то ЭДС измеряемого элемента будет равна потенциалу) правого электрода. Таким образом, электродный потенциал по водородной шкале Е – это ЭДС электрохимической системы, в которой справа расположен данный электрод, а слева – стандартный водородный электрод. |
4.5. Электролиз
| Электролизом называют процессы, происходящие на электродах под действием электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую. Ячейка для электролиза, называемая электролизером, состоит из двух электродов и электролита. Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока. |
 2015-04-01
2015-04-01 2482
2482
