 |
| Применение:изготовление минеральных удобрений, взрывчатых веществ, лекарственных веществ, красителей, пластических масс, искусственных волокон. |
| Соли азотной кислоты – нитраты NaNO3; KNO3; NH4NO3; Ca(NO3)2 – селитры |
Разложение нитратов:
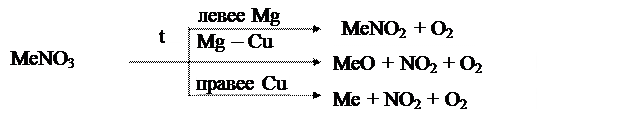 ФОСФОР P
ФОСФОР P
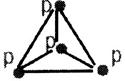
| В природе:фосфат кальция – фосфорит. 3Ca3(PO4)2·CaF2 – фторапатит. Фосфор – в составе белковых веществ |
| Аллотропные модификации | |||||
Белый фосфор
Бесцветное ядовитое вещество. Не растворим в воде, растворим в сероуглероде. При слабом нагревании превращается в красный фосфор. Легко плавится, летуч.
Молекулярная кристаллическая решетка. | Красный фосфор Красноватый порошок, не ядовит, не растворим в воде и сероуглероде. Атомная кристаллическая решетка. Нелетуч. | Черный фосфор По внешнему виду похож на графит, жирный на ощупь, свойства полупроводника, неядовит. Атомная кристаллическая решетка. Нелетуч. |
| Химические свойства |
  Р взаимодействует с О2, S, галогенами, кислотами, водой
4P+5O2=2P2O5; 3O2+4P=2P2O3 (недостаток О2);
2P+3S=P2S3; 2P+5Cl2(изб.)=2PCl5 и PCl5+4H2O=H3PO4+5HCl;
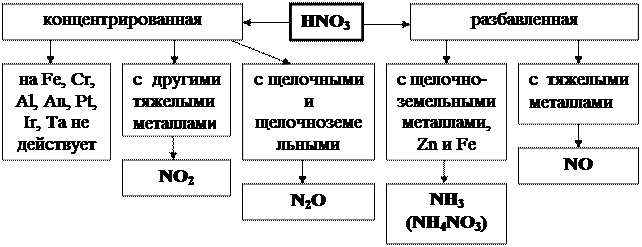
3P+5HNO3+2H2O=3H3PO4+5NO;
4P+3NaOH+3H2O=PH3+3NaH2PO2;
2P+3Ca=Ca3P2 – Р – окислитель. Р взаимодействует с О2, S, галогенами, кислотами, водой
4P+5O2=2P2O5; 3O2+4P=2P2O3 (недостаток О2);
2P+3S=P2S3; 2P+5Cl2(изб.)=2PCl5 и PCl5+4H2O=H3PO4+5HCl;
3P+5HNO3+2H2O=3H3PO4+5NO;
4P+3NaOH+3H2O=PH3+3NaH2PO2;
2P+3Ca=Ca3P2 – Р – окислитель.
|
| Получение: 2Ca3(PO4)2+10C+6SiO2= =6CaSiO3+P4+10CO; t=1500˚C | Применение Р: красный фосфор – производство спичек; белый фосфор – для дымовых завес. |
 2015-04-01
2015-04-01 475
475