Работа 1. Определение буферных свойств биологических жидкостей
Опыт 1 В четыре одинаковые пробирки с помощью пипетки отмеряют по 1 мл сыворотки крови. Первую пробирку оставляют для контроля, во вторую добавляют 5 кап. 0,025 N раствора NаОН, в третью - 0,025 N раствора НСl, в четвёртую – 5 кап. воды. Затем во все пробирки добавляют по 1-2 капли универсального индикатора и по цветной шкале универсального индикатора определяют приблизительное значение рН.
Опыт 2. В четыре одинаковые пробирки с помощью пипетки отмеряют по 1 мл ацетатного буфера. Первую пробирку оставляют для контроля, во вторую добавляют 5 кап. 0,025 N раствора NаОН, в третью - 0,025 N раствора НСl, в четвёртую – 5 кап. воды. Затем во все пробирки добавляют по 1-2 капли универсального индикатора и по цветной шкале определите приблизительное значение рН.
Опыт 3. В две одинаковые пробирки с помощью пипетки отмеряют: в первую – 5 кап. воды, во вторую 5 кап. слюны. Добавляют в каждую пробирку по 1-2 капли универсального индикатора и определяют примерное значение рН. Затем добавляют в обе пробирки по 1 капли 0,01 N раствора НСl.
Что наблюдаете? Охарактеризуйте буферные свойства слюны.
Результаты опытов заносят в таблицу № 1.
Таблица № 1.
| Исследуемый раствор | Значение рН по универсальному индикатору | Вывод об изменении рН раствора | |||
| Контроль-ный раствор | После добавления НСl | После добавле-ния NаОН | После добавления воды | ||
| 1. Сыворотка крови 2. Ацетатный буфер 3. Слюна |
Зависимость рН буферных растворов от соотношения компонентов
Опыт 1. В три пробирки с помощью пипетки отмеряют 0,2 N Nа2НРО4 и 0,2 N NаН2РО4 в количествах, указанных в таблице № 2. Добавляют в каждую пробирку по две капли универсального индикатора и определите рН по цветной шкале универсального индикатора.
Вычисляют рН исследуемых растворов по формуле Гендерсона – Гассельбаха:
рН = рК + ℓg 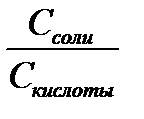 , Кд (Н2РО4-) = 1,5 · 10-7
, Кд (Н2РО4-) = 1,5 · 10-7
Делают вывод зависимости рН от соотношения концентраций компонентов буферной смеси.
Таблица № 2.
| № | Кол-во мл 0,2 N Nа2НРО4 | Кол-во 0,2 N NаН2РО4 | Соотношение Nа2НРО4 / NаН2РО4 | рН по индикатору | рН по формуле |
| 1. 2. 3. | 0,2 1,1 2,0 | 2,0 1,1 0,2 |
Тесты для самоконтроля.
Тест 1
1. Буферные растворы можно приготовить из:
а) HNO3 и КОН,
б ) СН3СООН и NaOH,
в) HCl и KNO3,
г) NH4OH и H2S
2. Щелочной резерв крови определяется количеством мл СО2 в объёмных % в расчете на:
а) 1000 мл,
б) 100 мл,
в) 10 мл,
г) 1,0 мл сыворотки крови.
3. Буферная ёмкость количественно определяется:
а) моль/экв сильной кислоты или основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН на единицу;
б) моль/л сильной кислоты или основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН на единицу;
в) числом мл слабой кислоты или основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН на единицу;
г) числом мл сильной кислоты или основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить его рН.
4. рН буферной системы зависит от:
а) концентрации компонентов,
б) объёма буфера,
в) разведения
г) соотношения концентрации компонентов.
5. При рН = 7,4 соотношение компонентов бикарбонатного буфера H2CO3/NaHCO3:
а) 1:20,
б) 20:1
в) 1:1
г) 1:5
Тест 2
1. При компенсированном алкалозе:
а) рН = 7,4, щелочной резерв 55 объемных %,
б) рН = 7,2, щелочной резерв 70 объемных %,
в) рН = 7,4, щелочной резерв 70 объемных %,
г) рН = 7,4, щелочной резерв 40 объемных %.
2. рН буферной системы зависит от:
а) объёма буфера,
б) концентрации компонентов,
в) разведения,
г) соотношения концентраций компонентов
3. При нейтрализации ионов водорода в почечной ткани принимает участие буферная система:
а) бикарбонатная,
б) фосфатная,
в) гемоглобиновая,
г) ацетатная.
4. Щелочной резерв крови – это количество мл СО2, находящегося в 100 мл сыворотки крови. В норме оно равно:
а) 24%,
б) 55%,
в) 35%,
г) 76%.
5. При разведении буферная ёмкость уменьшается, так как:
а) не изменяется соотношение компонентов,
б) увеличивается объём,
в) уменьшается концентрация,
г) изменяется соотношение компонентов.
Тест 3
1. Буферные растворы можно приготовить из:
а) HCl и KOH,
б) NH4OH и HCl,
в) NH4OH и H2S
г) KOH и H2SO4
2. При добавлении к аммиачному буферу НСl рН не меняется так как, в соответствии с законом разбавления Оствальда степень диссоциации слабого электролита:
а) увеличивается,
б) уменьшается,
в) не изменяется,
г) сначала увеличивается, а затем уменьшается.
3. Константа диссоциации NH4OH равна 1,8 · 10-5. Зона буферного действия будет находится в интервале рОН:
а) 3,8 – 5,8,
б) 2 – 4,
в) 4,8 – 5,8,
г) 2,8 – 4,8
4. При разведении в 10 раз буферного раствора рН:
а) уменьшается,
б) увеличивается
в) не изменяется,
г) сначала уменьшается, а затем увеличивается
5. В норме парциальное давление равно:
а) 60 мм рт.ст,
б) 20 мм рт.ст,
в) 50 мм рт.ст,
г) 40 мм рт.ст
Тест 3
1. Буферные растворы можно приготовить из:
а) HNO3 и КОН,
б ) СН3СООН и NaOH,
в) HCl и KNO3,
г) NH4OH и H2S
2. Щелочной резерв крови определяется количеством мл СО2 в объёмных % в расчете на:
а) 1000 мл,
б) 100 мл,
в) 10 мл,
г) 1,0 мл сыворотки крови.
3. Константа диссоциации СН3СООН равна 1,8 · 10-5. Зона буферного действия будет находится в интервале рОН:
а) 3,8 – 5,8,
б) 2 – 4,
в) 4,8 – 5,8,
г) 2,8 – 4,8
4. При нейтрализации ионов водорода в почечной ткани принимает участие буферная система:
а) бикарбонатная,
б) фосфатная,
в) гемоглобиновая,
г) ацетатная.
5. При компенсированном ацидозе:
а) рН = 7,4, щелочной резерв 55 объемных %,
б) рН = 7,2, щелочной резерв 70 объемных %,
в) рН = 7,4, щелочной резерв 70 объемных %,
г) рН = 7,4, щелочной резерв 40 объемных %.
Тест 5
1. При добавлении к ацетатному буферу NaOH рН не меняется так как, в соответствии с законом разбавления Оствальда степень диссоциации слабого электролита:
а) увеличивается,
б) уменьшается,
в) не изменяется,
г) сначала увеличивается, а затем уменьшается
2. Буферные растворы можно приготовить из:
а) HCl и KOH,
б) NaOH и H3PO4,
в) NH4OH и H2S,
г) KOH и H2SO4
3. В норме парциальное давление равно:
а) 60 мм рт.ст,
б) 20 мм рт.ст,
в) 50 мм рт.ст,
г) 40 мм рт.ст
4. При разведении в 100 раз ацетатного буферного раствора рН:
а) уменьшается,
б) увеличивается
в) не изменяется,
г) сначала уменьшается, а затем увеличивается
5. Щелочной резерв крови – это количество мл СО2, находящегося в 100 мл сыворотки крови. В норме оно равно:
а) 24%,
б) 55%,
в) 35%,
г) 76%.
 2015-04-01
2015-04-01 3469
3469
