Гальванические элементы являются химическими источниками электрической энергии. При работе гальванических элементов энергия ОВР преобразуется в электроэнергию. Принцип действия гальванических элементов рассмотрим на примере элемента Даниэля-Якоби (см. рисунок), в котором протекает окислительно-восстановительная реакция Zn + Cu+2 = Zn+2 + Cu:
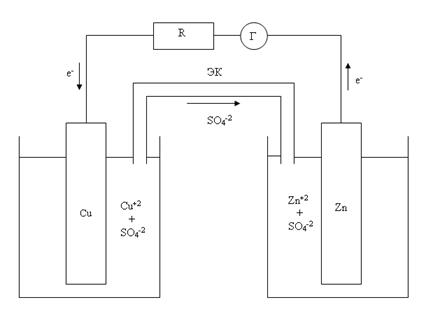
Этот гальванический элемент состоит из цинкового электрода, погруженного в раствор ZnSO4 и медного электрода, погруженного в раствор CuSO4. Растворы соединены между собой электролитическим ключом (ЭК)- устройством, позволяющим ионам SO4-2 переходить из одного раствора в другой. Оба раствора и электролитический ключ являются внутренней цепью гальванического элемента. Внешняя цепь в данном случае состоит из металлических проводов, резистора (R) и гальванометра (Г). Если внутренняя и внешняя цепи гальванического элемента замкнуты, то гальванометр регистрирует наличие во внешней цепи электрического тока. При этом на электродах самопроизвольно протекают процессы:
анод (-) Zn (тв) - 2e- = Zn+2 (aq)
катод (+) Cu+2 (aq) + 2e- = Cu (тв)
Катод имеет положительный заряд, а анод - отрицательный. При работе гальванического элемента в раствор ZnSO4 переходят избыточные ионы Zn+2, а в растворе CuSO4 появляются избыточные анионы SO4-2. Через электролитический ключ ионы SO4-2 переходят из раствора CuSO4 в раствор ZnSO4. В гальваническом элементе Даниэля-Якоби цинковая пластина - активный электрод, а медная - инертный.
ЭДС гальванического элемента (DE) равна разности электродных потенциалов катода и анода: DE = Eк - Eа.
ЭДС элемента Даниэля-Якоби при стандартных условиях (T = 298 K, p = 1,013.105 Па, [Zn+2] = [Cu+2 ] = 1 моль/л) равна разности стандартных электродных потенциалов цинка и меди:
DE = E°(Zn+2/Zn) - E°(Cu+2 /Cu) = + 0,34 В - (- 0,76 В) = 1,1 В.
Зная величину ЭДС гальванического элемента легко расчитать изменение энергии Гиббса (DG) для данного процесса:
DG = - zFDE,
где F - постоянная Фарадея (96 485 Кл/моль), z - количество электронов, переходящих от восстановителя к окислителю.
Нетрудно убедиться, что для гальванического элемента Даниэля-Якоби при стандартных условиях DG = -212,3 кДж/моль. Это означает, что процесс Zn + Cu+2 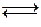 Zn+2 + Cu протекает в прямом направлении практически необратимо.
Zn+2 + Cu протекает в прямом направлении практически необратимо.
 2015-04-30
2015-04-30 612
612








