Схема химической реакции отражает ее качественную сторону и в ней указывают лишь химические формулы исходных веществ и продуктов реакции. Тем не менее схемы необратимых (идущих до конца) реакций, например, реакций разложения и сжигания, можно использовать для стехиометрических расчетов, учтя, что атомы, в отличие от молекул, являются химически неделимыми частицами и в ходе химической реакции количество и масса атомов каждого элемента сохраняется. Следствием этого положения является закон сохранения массы веществ в необратимой химической реакции: масса веществ, взятых для реакции, равна массе продуктов реакции плюс масса остатка вещества, взятого в избытке.
Таким образом, все вычисления по схеме реакции основаны на составлении уравнений материального баланса по количеству вещества или массе каждого элемента с последующим использованием соотношений, связывающих количество данных атомов с количеством вещества реагентов и продуктов реакции, в составе которых они находятся (см. расчеты по химическим формулам веществ).
Методику расчетов по схемам реакций обычно используют при решении задач на установление индексов в химической формуле исходного вещества по данным о продуктах его сжигания или разложения (см. пример 1). Кроме того, используя закон сохранения количества атомов данного элемента, можно значительно упростить решение задач, где речь идет о расчетах по цепочкам химических реакций, когда продукт одной реакции является исходным веществом для другой (см. пример 2).
Пример 1. Схема сжигания некоторого органического вещества CxHyOzNkCln (обозначим его для краткости L) в избытке кислорода имеет вид:
CxHyOzNkCln+O2 (избыток) ® CO2+H2O+N2+HCl+O2 (остаток)
Индексы в простейшей химической формуле сожженного вещества могут быть определены на основе следующих уравнений материального баланса:
– закон сохранения массы:
m(L)+m(O2/исх) = m(CO2) +m(H2O)+m(N2)+m(HCl)+m(O2/ост)
– уравнения баланса по количеству атомов:
а) по атомам С: n(C/L)= n(C/CO2)= n(CO2)
б) по атомам Н: n(H/L)= n(H/H2O)+ n(H/HCl)=2n(H2O)+ n(HCl)
в) по атомам N: n(N/L)= n(N/N2)=2n(N2)
г) по атомам Cl: n(Cl/L)= n(Cl/HCl)= n(HCl)
д) по атомам О:
n(O/L)+ n(O/O2 исх)= n(O/CO2)+ n(O/H2O)+ n(O/O2 ост)
или n(O/L)=2n(CO2)+ n(H2O)+2n(O2 ост)-2n(O2 исх),
но если известна масса исходного вещества L, то расчет упрощается:
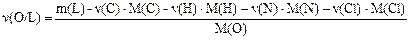 Необходимые для расчета количества вещества продуктов реакции CO2, H2O, N2 и HCl определяют обычным образом из условия задачи и далее находят индексы в простейшей формуле исходного вещества:
Необходимые для расчета количества вещества продуктов реакции CO2, H2O, N2 и HCl определяют обычным образом из условия задачи и далее находят индексы в простейшей формуле исходного вещества:
x: y: z: k: n = n(C): n(H): n(O): n(N): n(Cl)
Пример 2. Какое предельное количество серной кислоты можно получить из заданной массы m0 пирита, содержащего а % примесей. Считать выход продуктов реакции на каждой стадии процесса за 100%.
Цепочка превращений имеет вид:
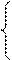 FeS2 + O2 ® Fe2O3 + SO2
FeS2 + O2 ® Fe2O3 + SO2
SO2 + O2 ® SO3
SO3 + H2O ® H2SO4
и, если на всех стадиях процесса нет технологических потерь, то все атомы серы из FeS2 перешли в H2SO4:
n(S/FeS2) = n(S/H2SO4) или 2n(FeS2) = n(H2SO4)
или 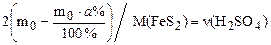 ,
,
где m0 – масса исходной руды, г.
 2015-04-30
2015-04-30 448
448








