Еще в 1865 г Николай Николаевич Бекетов [[2]] предположил, что атомы должны состоять из более мелких частиц, вращающихся относительно друг друга [[3]]. Такое строение, по его мнению, могло бы объяснить выделение энергии при химических реакциях.
После открытия электрона в 1897 г. Джозефом Джоном Томсоном [[4]] им же была предложена первая атомная модель "пудинга с изюмом" – в положительную сферу вкраплены электроны (1903 г.).
В 1904 г. японский физик Хантаро Нагаока [[5]] предложил модель “сатурноподобного” атома, в котором электроны вращаются по кольцевой орбите вокруг положительного ядра.
Ученик Томсона Эрнест Резерфорд в результате знаменитых экспериментов по рассеянию золотой фольгой a-частиц "разделил" атом на маленькое положительное ядро и окружающие его электроны [[6]]. Однако, согласно законам классической механики и электродинамики, вращение электрона вокруг ядра должно сопровождаться электромагнитным излучением с непрерывным спектром. Это противоречило известным с 1880 г. линейчатым спектрам газов и паров элементов.
(Фрагмент из лекции 1):
Предположим, что в начале XX века Э.Резерфорд (1871-1937) и его молодые сотрудники Ганс Вильгельм Гейгер (1882-1945) и Эрнест Марсден (1889-1970) получили для своих экспериментов с рассеянием a-частиц компьтеризированную установку. Она легко воспроизвела бы основной результат, что наиболее вероятный угол рассеяния a- частиц на золотой фольге толщиной 4*10–5 см составляет 0,870. Для тех же чрезвычайно редких (1 из 20000 измерений) случаев рассеяния на угол более 900 согласно центральной предельной теореме теории вероятностей достоверность эксперимента составляет 3*10–2174 (это не опечатка!); поэтому компьютер со стандартной программой без малейшего сомнения отбросил бы такие “случайные ошибки”. И осталась бы наука без планетарной модели атома, по крайней мере на несколько десятков лет. Только великолепная интуиция Резерфорда позволила ему сделать вывод, что чрезвычайно редкие “случайные” результаты истинны, и на их основе изменить физическую модель атома (вместо “пудинга с изюмом” Дж.Томсона (1856-1940) подобие солнечной системы).
Противоречие разрешил ученик Резерфорда Нильс Бор [[7]] в 1913 г., разработав квантовую модель атома на основе квантовой теории излучения и поглощения света, созданной Максом Планком и Альбертом Эйнштейном. При этом удалось объяснить и рассчитать теоретически линейчатые спектры испускания атомов водорода, а также серии линий в рентгеновских спектрах элементов.
Еще в 1885 г. швейцарский школьный учитель и одновременно доктор Базельского университета Иоган Бальмер предложил простую формулу для расчета частот линий испускания водорода в видимой области:
n = R(1/k2 – 1/n2)
где n – частота, R – постоянная [3,29*1015 гц ],
k = 2; n = 1,2,3,...
Позже в инфракрасной области были обнаружены другие серии спектральных линий с k = 3,4,5.
Бор выдвинул предположение, что атом водорода (система протон-электрон) может находиться только в определенных стационарных энергетических состояниях (электрон – на определенных орбитах), причем одно из них соответствует минимуму энергии и является основным (невозбужденным). Испускание или поглощение атомом энергии может происходить, согласно теории Бора, только при переходах электрона из одного энергетического состояния в другое (с одной орбиты на другую). Для R в формуле Бальмера Бор нашел следующее выражение:
R = [(2p2me4)/(ch3)] (1)
где m и e – масса и заряд электрона, c – скорость света в вакууме, h – постоянная Планка.
При этом Бор предсказал существование серии линий испускания в ультрафиолетовой области (k = 1), которые затем были обнаружены в 1915 г. Теодором Лайманом.
В терминах "стационарных электронных оболочек (орбит)" удалось наглядно объяснить существование характеристического рентгеновского излучения для разных элементов, использованных в качестве анода в рентгеновской трубке.
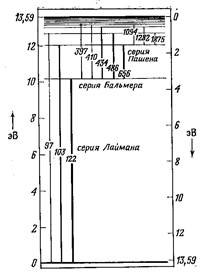
Рисунок 1. Уровни энергии и переходы в атоме водорода [[8]]
Впервые обнаруживший в 1910 г. характеристические лучи Чарльз Баркла (Англия) решил обозначить буквой K лучи с наибольшей проникающей способностью (наименьшей длиной волны), оставляя другие буквы для для возможных лучей с большей и меньшей проникающей способностью. Однако впоследствии удалось обнаружить только более мягкие лучи, получившие обозначения L, M, N. В результате систематических исследований рентгеновских спектров элементов Генри Мозли [[9]] (Англия) и Вальтер Коссель (Германия) предложили в 1914 г оболочечную модель строения атома. Согласно этой теории на каждой из оболочек может содержаться несколько электронов с примерно одинаковой энергией. Тогда появление серий рентгеновских лучей можно легко объяснить переходами электронов между оболочками:
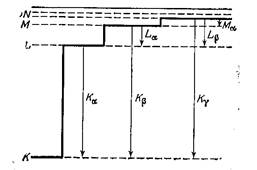
Рисунок 2. Появление серий излучения в рентгеновских спектрах [[10]].
Благодаря исследованиям рентгеновских спектров Мозли сумел определить заряды ядер элементов и показал, что они равны их порядковым номерам в периодической таблице. Кроме того, он предсказал существование еще не открытых элементов с номерами 43, 61, 72, 75.
Теория Бора позволяла очень точно вычислить положение линий в спектре испускания атомарного водорода. Однако она не могла предсказать соотношение интенсивностей линий даже в этой простейшей системе. Для систем, содержащих более одного электрона, например атома гелия, теория Бора уже не давала точных значений спектральных линий. Поэтому в 1925-26 гг. Вернером Гейзенбергом (Германия) и Эрвином Шредингером (Австрия) была разработана новая теория квантовой (волновой) механики.
 2015-04-20
2015-04-20 452
452








