Различают четыре уровня структурной организации белковых молекул.
Первичная структура белка – это число и последовательность аминокислотных остатков в полипептидной цепи. (Полипептидную теорию строения белков предложил немецкий химик Э.Шифер в начале ХХ в.).
В организме человека свыше 10000 различных белков, и все они построены из одних и тех же 20 α-аминокислот (формулы некоторых из них приведены в табл. 1), которые соединены между собой пептидными связями. Число остатков аминокислот в молекулах белков варьирует от 50 до 105. Потенциально возможное число белков с различной первичной структурой практически не ограничено.
Фрагмент полипептидной цепи:
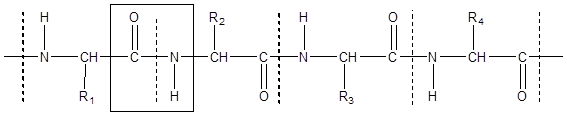
Пептидная группа Аминокислотный остаток – структурное
звено полипептида
R1, R2, R3, R4 – радикалы α-аминокислот.
Один из первых белков, первичная структура которого была установлена в 1954 г., - гормон инсулин (регулирует содержание сахара в крови), его молекула состоит из двух полипептидных цепей, которые связаны друг с другом (в одной цепи 21 аминокислотный остаток, в другой – 30), Мг(инсулина) 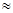 5700.
5700.
Другой белок – фермент рибонуклеаза – состоит из 124 аминокислотных остатков и имеет Мг  15000.
15000.
Белок крови – гемоглобин имеет Мг  68000.
68000.
Белки некоторых вирусов имеют Мг до 50 млн.
Относительная молекулярная масса белков изменяется в широких пределах: от 5 тыс. до десятков миллионов.
Вторичная структура белка (для большинства белков) – это α-спираль, которая образуется в результате скручивания полипептидной цепи за счет водородных связей между группами:
Теоретически все –С– и –N– группы могут участвовать в образовании


О Н
водородных связей, поэтому вторичная структура очень стабильна.
В одном витке спирали обычно содержится 3,6 аминокислотного остатка.
Вторичная структура была установлена американским химиком Л. Полингом в 1951 г.
Существуют белки, имеющие другие типы вторичной структуры.
|
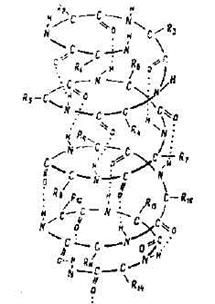
Третичная структура белка – пространственная конфигурация спирали.
У большинства белков полипептидные цели свернуты особым образом в «клубок» - компактную «глобулу» (рис. 2). Эта структура поддерживается за счет гидрофобных взаимодействий, а также водородных, дисульфидных, ионных и других связей.

Рис. 2. Третичная структура белковой молекулы («глобула»).
В количественном отношении наиболее важны гидрофобные (от греч. «гидро» - вода, «фобос» - страх) взаимодействия.
Белок в водном растворе свертывается таким образом, чтобы его гидрофобные (водоотталкивающие) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повернуты наружу.
В результате взаимодействия между различными функциональными группами полипептидной цепи образуются: дисульфидные мостики (-S-S-), в создании которых участвуют атомы серы серусодержащих аминокислот (например, цистеина); солевые мостики (NH3+COO-) – получаются при взаимодействии карбоксильных и аминогрупп (ионная связь); сложноэфирные мостики
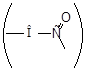
- результат взаимодействия карбоксильных и гидроксильных групп.
Существуют белки, у которых третичная структура почти или совсем не выражена.
Четвертичная структура белка – способ совместной укладки нескольких полипептидных цепей; образующиеся структуры называются ассоциатами.
Например, гемоглобин (белок крови) – это сложный белок, макромолекула которого состоит из четырех полипептидных цепей (глобул), соединенных с четырьмя гемами – небелковыми образованиями, которые и придают крови красный цвет. В каждом геме содержится один атом двухвалентного железа, который может непрочно связывать одну молекулу кислорода. В результате такого связывания образуется оксигемоглобин, одна молекула которого переносит к тканям четыре молекулы кислорода.
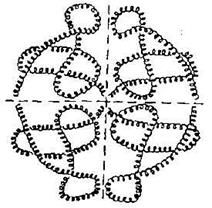
Рис. 3. Четвертичная структура белка (ассоциат, образованный
четырьмя полипептидными цепями).
Из тканей гемоглобин выносит углекислый газ, молекулы которого присоединяются к аминогруппам, содержащимся в полипептидных цепях.
 2015-05-06
2015-05-06 1351
1351
