Современные теории ковалентной связи основаны на представлениях квантовой механики. Согласно принципам квантовой механики состояние электрона в атоме определяется волновой функцией, которую называют атомной орбиталью. Образование химической связи между атомами рассматривается как результат взаимодействия двух орбиталей, на каждой из которых находится по одному электрону. При этом происходит образование молекулярных орбиталей (МО). Из двух атомных орбиталей образуются две молекулярные орбитали, одна из которых (связывающая) имеет более низкую энергию, а другая (разрыхляющая) – более высокую энергию, чем исходные АО.
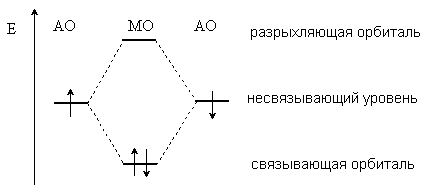
Электроны связи занимают более низкую по энергии связывающую орбиталь, таким образом, взаимодействие орбиталей приводит к выигрышу в энергии.
В зависимости от типа комбинирующихся атомных орбиталей образуются разные типы МО. Определяющую роль в этом играют симметрия и узловые свойства орбиталей. Атомные s-орбитали имеют симметрию шара и не имеют узловых поверхностей, проходящих через центр атома. Атомные p-орбитали имеют цилиндрическую симметрию и три состояния px, py и pz. Каждая p-орбиталь имеет узловую плоскость, проходящую через центр атома и перпендикулярную соответственно оси x, y или z.
|
|
|
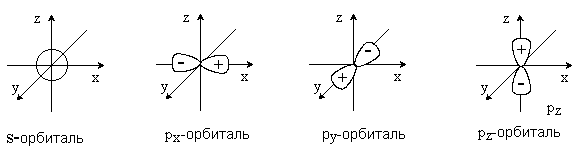
Узловая поверхность – это место, где вероятность нахождения электрона равна нулю, а волновая функция меняет знак. Чем больше узлов, тем выше энергия орбитали. Таким образом, p-орбиталь состоит из двух частей, в которых знаки волновых функций противоположны.
При комбинировании по оси х двух s-орбиталей, s-орбитали и px-орбитали или двух px-орбиталей образуются s -МО: связывающие (s) и разрыхляющие (s *).
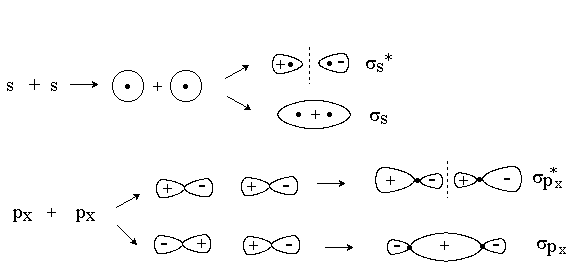
s -МО имеют цилиндрическую симметрию. Разрыхляющие s*-МО имеет узловую плоскость, проходящую между ядрами.
При комбинировании вдоль оси х двух ру или двух рz-орбиталей образуются МО p -типа.
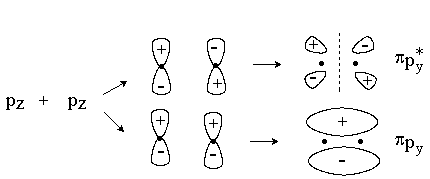
Связывающая p -МО имеет узловую плоскость, проходящую через линию, соединяющую ядра атомов. Разрыхляющая p *-МО имеет, кроме того, узловую плоскость, проходящую между ядрами.
При рассмотрении электронного строения многоатомных молекул необходимо использовать такой набор орбиталей, при котором достигается их максимальное перекрывание. В связи с этим водится понятие гибридизации орбиталей. Атом углерода в возбужденном состоянии содержит четыре неспаренных электрона на внешнем энергетическом уровне и способен образовать четыре ковалентных связи.
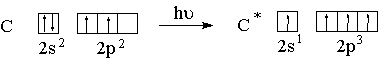
В образовании связей участвуют гибридные орбитали.
Первое валентное состояние – sp 3-гибридизация. В результате гибридизации с участием одной s и трех p орбиталей атома углерода образуются четыре эквивалентные sp3-гибридные орбитали, направленные к вершинам тетраэдра под углами 109,5о:
|
|
|
В состоянии sp3-гибридизации атом углерода образует четыре s -связи с четырьмя заместителями и имеет тетраэдричекую конфигурацию с валентными углами, равными или близкими 109,5о:
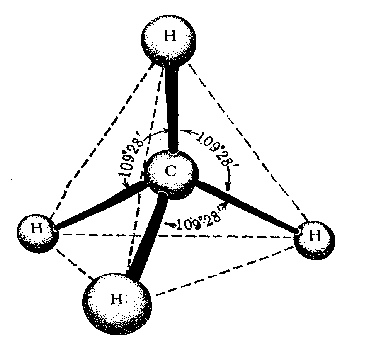
Метан
Второе валентное состояние – sp 2-гибридизация. В результате гибридизации с участием одной s- и двух p-орбиталей атома углерода образуются три эквивалентные sp2-гибридные орбитали, лежащие в одной плоскости под углами 120о, а не участвующая в гибридизации p-орбиталь расположена перпендикулярно плоскости гибридных орбиталей.
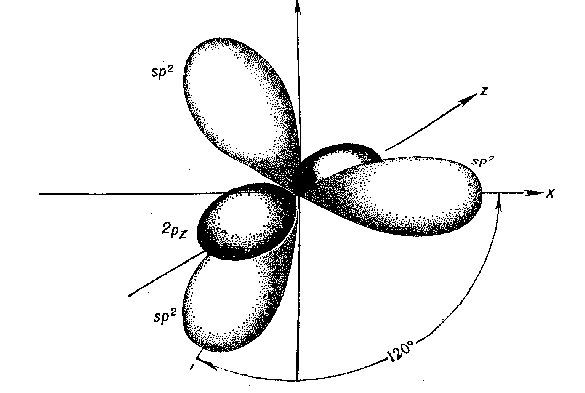
В состоянии sp2-гибридизации атом углерода образует три s -связи за счет гибридных орбиталей и одну p -связь за счет не участвующей в гибридизации p-орбитали и имеет три заместителя:
Этилен
Третье валентное состояние углерода – sp-гибридизация. В результате гибридизации с участием одной s- и одной p–орбитали образуются две эквивалентные sp-гибридные орбитали, лежащие под углом 1800, а не участвующие в гибридизации p-орбитали расположены перпендикулярно плоскости гибридных орбиталей и друг другу. В состоянии sp-гибридизации атом углерода образует две s -связи за счет гибридных орбиталей и две p -связи за счет не участвующих в гибридизации p-орбиталей и имеет два заместителя:

Ацетилен
Таблица 3.1. Зависимость структуры соединений от типа гибридизации углерода.
| Тип гибридизации | Число заместителей | Геометрия и валентный угол | Примеры |
| sp3 | Тетраэдрическая 109,5 | CH4, CCl4, CH3OH | |
| sp2 | Тригональная | CH2=CH2,
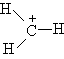
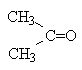
| |
| sp | Линейная | HCº CH CH3Cº N O=C=O CH2=C=O |
 2015-04-23
2015-04-23 3876
3876








