Осмос, осмотическое давление. Биологическое значение осмоса. Понятие об изотонических, гипертонических и гипотонических растворах.
Осмос – диффузия вещества, обычно растворителя, через полупроницаемую мембрану, разделяющую раствор и чистый растворитель или два раствора с разной концентрацией. Полупроницаемая мембрана — перегородка, пропускающая малые молекулы растворителя, но непроницаемая для более крупных молекул растворённого вещества. Выравнивание концентраций по обе стороны такой мембраны возможно лишь при односторонней диффузии растворителя. Поэтому всегда идёт от чистого растворителя к раствору или от разбавленного раствора к концентрированному.
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
|
|
|
Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим.
Осмос играет важную роль.
· Мембрана, расположенная вокруг нормальной клетки крови пропускает только нужные ей вещества, а крупные молекулы белка не могут проникнуть в клетку.
· Осмос участвует в переносе питательных веществ в стволах высоких деревьев.
· Используется при определении малярных характеристик полимера.
· Для получения некоторых полимеров.
· Играет большую роль в экологии водоемов.
Буферные растворы и буферная емкость. Буферные системы живого организма и их значение.
Буферные растворы — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (например, СН3СООН и CH3COONa) или слабого основания и его соли (например, NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях.
Буферная ёмкость — определяет способность раствора сохранять постоянной концентрацию определённых ионов (обычно применяется к ионам H+) при условии, что в растворе протекают химические реакции, или при добавлении к раствору электролитов.
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор и др.).
|
|
|
2. Классификация аминокислот, их строение и номенклатура. Образование пептидной связи.
Аминокислоты – органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Общая структурная формула аминокислот:
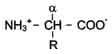
В каждой молекуле аминокислоты присутствует атом углерода, связанный с четырьмя заместителями.
· Один из них — атом водорода
· второй — карбоксильная группа — СООН. От карбоксильной группы легко отделяется ион водорода Н+, благодаря чему в названии аминокислот и присутствует слово «кислота»
· Третий заместитель — аминогруппа — NH2.
· Четвертый элемент аминокислоты — группа атомов, которую в общем случае обозначают R (радикал).
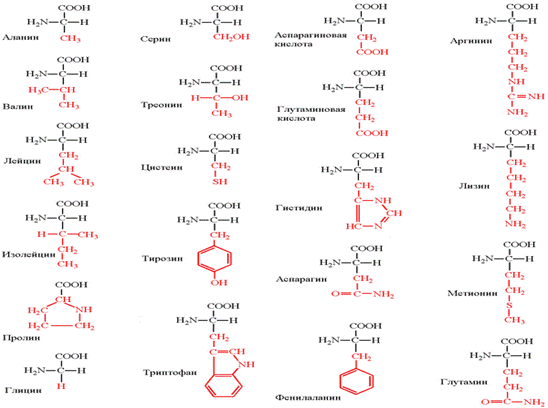
Классификация аминокислот:
Из-за разнообразного строения и свойств классификация аминокислот может быть различной, в зависимости от выбранного качества аминокислот. Аминокислоты подразделяются:
1. В зависимости от положения аминогруппы по отношению к С2 (α-углеродный атом) на α-аминокислоты, β-аминокислоты и др.
2. По абсолютной конфигурации молекулы на L- и D-стереоизомеры.
3. По оптической активности в отношении плоскости поляризованного света – на право- и левовращающие.
4. По участию аминокислот в синтезе белков – протеиногенные и непротеиногенные.
5. По строению бокового радикала – ароматические, алифатические, содержащие дополнительные СООН- и NH2-группы.
6. По кислотно-основным свойствам – нейтральные, кислые, основные.
7. По необходимости для организма – заменимые и незаменимые.
Образование пептидной связи:
 2015-04-30
2015-04-30 1408
1408







