В основе микрохимического анализа лежит свойство некоторых солей образовывать характерной формы кристаллы, по которым можно судить о наличии в составе золы того или иного элемента.
Материалы и оборудование:
1. Растения: зола из заготовленных летом высушенных листьев, стеблей, соцветий, плодов и кусочков древесины различных растений, полученная в опыте № 1.
2. Микроскоп.
3. Стеклянные тонкие палочки с оттянутыми концами, предметные стекла.
4. Пробирки.
5. Воронки.
6. Фильтровальная бумага.
7. Бумажные фильтры.
8. Этанол.
10. 10% раствор HCl.
11. 1% растворы кислот H2SO4, HNO3, H2C2O4.
12. 1% растворы солей NaHC4Н4O6, PtCl4, K4[Fe(CN)6], Hg2(NO3)2, (NH4)2MoO4, (CH3COO)2Pb, AgNO3, Na2HPO4.
13. Смесь следующего состава: 1 г Na2HPO4, 4 г NH4Cl, 6 г NH4OH, 2 г лимонной кислоты в 250 мл воды (реактив на магний).
Ход работы:
Из золы, полученной в предыдущем опыте, готовят в пробирках два раствора – водный для выявления Cl- и K+ и солянокислый для определения всех остальных ионов. Одну вторую часть золы заливают 3 мл дистиллированной воды, перемешивают и отфильтровывают в чистую пробирку.
С растворами проделывают все качественные реакции. Появление типичных кристаллов показывает наличие в золе соответствующих элементов.
Техника проведения реакции показана на рис. 1.
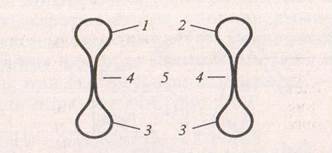
Рис. 1. Техника проведения реакции:
1 – вытяжка из золы; 2 – раствор, содержащий обнаруживаемый элемент; 3 – реактив на обнаруживаемый элемент; 4 – «мостик» между раствором и реактивом; 5 – предметное стекло.
Следует заметить, что для сохранения чистоты реактивов каждый из них берут отдельной стеклянной палочкой. Для удобства палочку укрепляют в пробке, которой закрывают данный реактив. После использования палочки следует тщательно мыть и вытирать фильтровальной бумагой.
На разные концы предметного стекла помещают по капле необходимого реактива на ион, который хотят выявить. Рядом с одной из них наносят каплю какой-либо соли, содержащей данный ион, а с другой – каплю солянокислого или водного экстракта золы. Чистой стеклянной палочкой с заостренным концом две соседние капли соединяют перемычками. В результате взаимодействия растворов образуются продукты реакции, которые при медленном подсушивании препарата будут выпадать в осадок с образованием характерных кристаллов. Следует избегать полного перемешивания капель растворов: самые крупные и правильно сформированные кристаллы образуются в тонких перемычках между каплями. Очень важно правильно подсушить препарат. Для этого его держат высоко над пламенем горелки и подогревают до полного испарения воды, слегка перемещая из стороны в сторону. Подсушивание прекращают, как только исчезнет последняя капля жидкости. Кристаллы рассматривают под микроскопом на сухом препарате без покровного стекла, зарисовывают и сравнивают с контрольным вариантом.
Проделывают все качественные реакции с растворами и экстрактами золы. Появление типичных кристаллов показывает наличие соответствующих элементов в золе.
1. Обнаружение ионов калия:
а) реактивом на ионы калия может быть гидротартрат натрия NaHC4Н4O6, который с нейтральным раствором солей калия дает осадок гидротартрата калия КHC4Н4O6в виде крупных призм и пластинок (рис. 2)
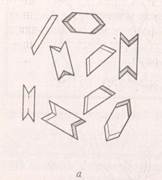
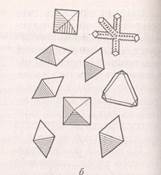
Рис. 2. Кристаллы гидротартрата калия (а) и хлорплатината калия (б).
Кристаллы гидротартрата хорошо растворяются в кислотах и щелочах, поэтому для определения иона калия берут водный экстракт;
б) ионы калия можно обнаружить также с помощью хлорида платины PtCl4. В этом случае выпадают кристаллы хлороплатината калия К2PtCl6, (рис. 2) в виде тетраэдров, октаэдров и кубов желтовато-зеленого цвета.
2) Обнаружение ионов кальция:
а) на предметном стекле каплю испытуемого раствора и контрольного раствора соединяют с каплями щавелевой кислоты. При медленном нагревании выпадают кристаллы оксалата кальция CaC2O4∙3H2O в виде октаэдров, кубов, иногда крестов (рис. 3).
Б) более характерным реактивом на кальция является серная кислота. В результате этой реакции при той же технике выполнения выпадают игольчатые кристаллы гипса CaSO4∙2H2O, которые иногда располагаются группами, напоминающими снежинки;
CaCl2 + H2SO4 → CaSO4 + 2HCl

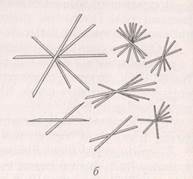
Рис. 3. Кристаллы оксалата кальция (а) и гипса (б).
3. Обнаружение ионов магния:
Капли испытуемого раствора и контрольной соли соединяют с реактивом, состоящим из гидрофосфата натрия, хлорида аммония, лимонной кислоты и гидроксида аммония. При медленной кристаллизации выпадают кристаллы фосфата магния-аммония в виде трапеций, призм и октаэдров; при быстрой кристаллизации – в виде звезд, крестов и ветвящихся образований (рис. 4):
MgCl2 + Na2HPO4 + NH4OH → NH4MgPO4 + 2NaCl.
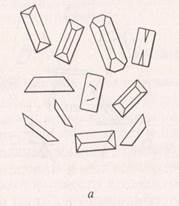
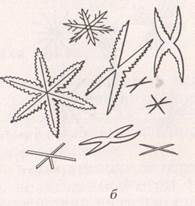
Рис. 4. Кристаллы фосфата магния-аммония, полученные: а – при медленной, б – при быстрой кристаллизации.
4. Обнаружение ионов железа:
Присутствие в вытяжке ионов железа Fe3+ обнаруживают при взаимодействии с гексацианоферратом (II) калия K4[Fe(CN)6]. В результате образуется интенсивно-синий осадок гексоцианоферрата (II) железа Fe 4[Fe(CN)6]3.
Железа в некоторых образцах золы мало, поэтому исходную вытяжку следует нанести на стекло несколько раз и выпарить. Наличие ионов железа выявляют по синей окраске:
4FeCl3 + 3 K4[Fe(CN)6] → Fe 4[Fe(CN)6]3↓ + 12 KCl.
Реакцию на железо можно проводить в пробирке с частью солянокислого экстракта, к которому по каплям прибавляют раствор гексацианоферрата (II) калия.
5. Обнаружение фосфора:
а) растворы солей фосфорной кислоты образуют с нитратом ртути Hg2(NO3)2 кристаллический осадок фосфата ртути Hg3PO4 в виде розеток или пучков игл;
б) ионы PO43- можно обнаружить в растворе при взаимодействии с молибдатом аммония (NH4)2MoO4. Каплю раствора фосфорной кислоты, слегка подкисленную азотной кислотой, соединяют с каплей раствора молибдата аммония. В результате выпадают зеленовато-желтые мелкие кристаллы сложной комплексной соли (рис.5):
HPO43- + 3NH4+ + 12 MoO42- + 24H+ → (NH4)3[P(Mo3O10)4] ↓ + 12H2O.
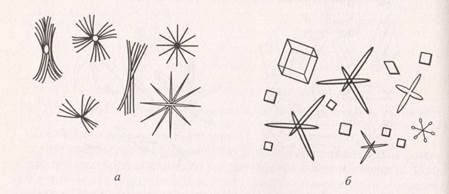
Рис. 5. Кристаллы фосфата ртути (а) и фосфат-молибдата аммония (б)
6. Обнаружение ионов SO42-:
а) в качестве реактива используют раствор ацетата свинца (CH3COO)2Pb. Выпадают очень мелкие кристаллы сульфата свинца в виде длинных игл, звезд и ромбов;
б) в присутствии нитрата серебра AgNO3 осаждаются кристаллы сульфата серебра Ag SO4 в форме вытянутых шестиугольников и ромбов. Трение стеклянной палочкой на холоде по стеклу в капле продуктов реакции ускоряет выпадение осадка (рис. 6).
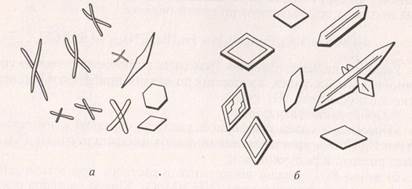
Рис. 6. Кристаллы сульфата свинца (а) и сульфата серебра (б).
7. Обнаружение ионов хлора:
Анионы хлора обнаруживают в водном растворе золы нитратом серебра AgNO3. При взаимодействии хлора с этим реактивом выпадает белый осадок AgCl2, который и служит доказательством присутствия ионов хлора в растворе.
Задание: при оформлении работы записать уравнения реакций и зарисовать характерные формы кристаллов. В выводе отметить, какое количество золы в процентах от сухой массы содержится в данном органе и какие элементы обнаружены в золе исследуемых растений.
 2015-05-10
2015-05-10 7677
7677







