Если к раствору слабой кислоты прибавить ее соль, то степень диссоциации кислоты понижается, следовательно, концентрация водородных ионов уменьшается. Диссоциация слабой кислоты подавляется также в присутствии сильной кислоты: в этом случае уменьшается концентрация ее анионов.
Аналогичное явление имеет место в растворах слабых оснований при добавлении сильных электролитов, содержащих одноименный ион.
В растворе слабой кислоты НА в присутствии ее соли МА равновесие реакции (1.1) смещается в сторону образования недиссоциированных молекул НА. Концентрации ионов, образующихся при диссоциации кислоты, будут в данном случае очень малы. Поэтому концентрацию недиссоциированных молекул кислоты можно считать равной общей концентрации кислоты С НА, а концентрация анионов А- может быть принята равной концентрации соли (С А-), которая в растворе практически полностью диссоциирована.
[НА] = С НА,
[А-] = С А-.
Подставив эти значения в уравнение (1.20), найдем [Н+] и α
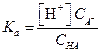
| (1.87) |
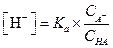
| (1.88) |
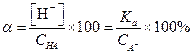
| (1.89) |
Аналогичным образом можно рассчитать концентрацию ОН- и α в растворах слабых оснований (ВОН) в присутствии их солей (ВХ). В этом случае концентрацию ВОН принимают равной общей концентрации основания Свон, а концентрацию катионов В+ - концентрации соли (Св+)
|
|
|
[ВОН] = С ВОН; [В+] = С В+.
Подставив эти значения в выражение для константы диссоциации слабого основания, получим
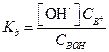
| (1.90) |
Отсюда
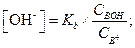
| (1.91) |
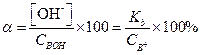
| (1.92) |
Рассмотрим равновесие в растворе слабой одноосновной кислоты при заданном рН. Общая концентрация кислоты складывается из концентрации недиссоциированных молекул НА иионов А-.
| С на = [НА] + [А-]. | (1.93) |
Из уравнения (1.20) следует
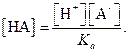
| (1.94) |
Подставив это значение в уравнение (1.93), получим
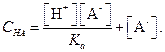
| (1.95) |
Решая это уравнение относительно [А-], найдем
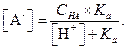
| (1.96) |
Уравнение (1.96) позволяет рассчитать концентрацию анионов слабой кислоты при заданной концентрации водородных ионов.
При избытке сильной кислоты, когда концентрация значительно превышает значение Ка уравнение (1.96) принимает вид
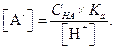
| (1.97) |
В растворах многоосновных кислот при данном рН наряду с недиссоциированными молекулами кислоты H n A могут присутствовать ионы различного состава (Нn-1А-, Нn-2А2-, … Аn-), и общая концентрация кислоты будет равна
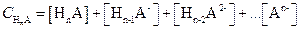
| (1.98) |
Рассмотрим расчеты равновесных концентраций анионов и недиссоциированных молекул на примере слабой двухосновной кислоты Н2А. В этом случае
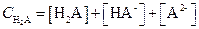
| (1.99) |
Запишем выражения для констант диссоциации кислоты
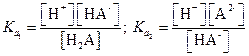
|
Найдем значения [Н2А] и [НА-]
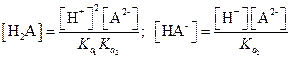
|
Подставим эти значения в уравнение (1.99)
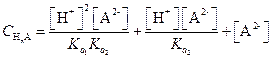
| (1.100) |
Решая последнее уравнение относительно [А2-], получим
|
|
|
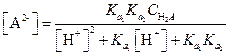
| (1.101) |
Аналогично можно найти значения [HA-] и [Н2А]
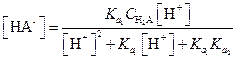
| (1.102) |
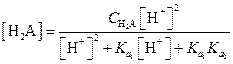
| (1.103) |
В общем случае в растворе любой слабой многоосновной кислоты НnА в соответствии с уравнением (1.98) и учетом констант диссоциации кислоты равновесные концентрации недиссоциированных молекул и анионов могут быть рассчитаны по следующим уравнениям:
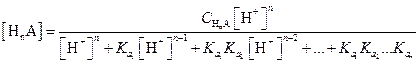
| (1.104) |
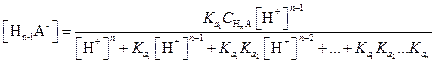
| (1.105) |
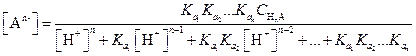
| (1.106) |
Пример 21. Вычислить α, [Н+] и рН 0.4 М раствора уксусной кислоты, к литру которого добавлено 16.4 г ацетата натрия.
Решение. Находим концентрацию ацетата натрия (СА-) в М, (М. м. CH3COONa = 82)
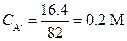
|
По уравнению (1.89) вычисляем α
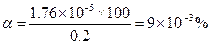
Находим концентрацию Н+-ионов по уравнению (1.88)
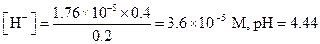
Пример 22. Как изменится рН и α 1.0 М раствора NH3 после добавления к нему сухого хлорида аммония в таком количестве, что раствор становится 0.2М в отношении NH4C1?
Решение. До добавления соли в исходном растворе концентрация ОН- была равна
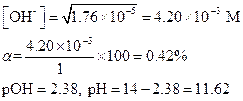
После введения соли
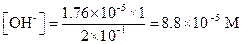
pOH = 4.06; pH = 14-4.06 = 9.94
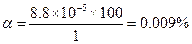
Пример 23. Вычислить концентрацию ацетат-иона и степень диссоциации уксусной кислоты, если к 20 мл 0.5 М раствора ее прибавить 30 мл 10%-ного раствора НСl.
Решение. Находим концентрации СН3СООН (С НА) и Н+:
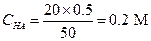
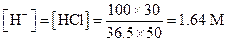
Поскольку [H+] значительно превышает константу диссоциации уксусной кислоты, для расчета концентрации ацетат-иона можно использовать уравнение (1.97).
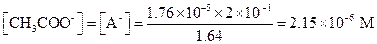
Находим степень диссоциации α:
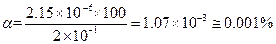
Пример 24. Вычислить концентрации HS- и S2--ионов в насыщенном растворе H2S, если рН раствора равен 4.
Решение. В насыщенном растворе 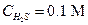 . Константы диссоциации сероводородной кислоты равны
. Константы диссоциации сероводородной кислоты равны 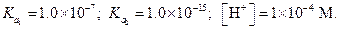 Применив уравнение (1.101) и уравнение (1.102), найдем:
Применив уравнение (1.101) и уравнение (1.102), найдем:
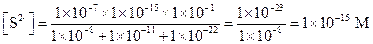
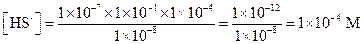
Пример 25. Рассчитать равновесную концентрацию НРО42- при рН = 7, если общая концентрация соли равна 0.1 М.
Решение.
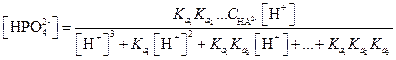 =
=
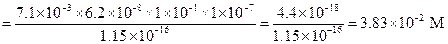
 2015-05-13
2015-05-13 5335
5335
