Пример 1. Определите процентную концентрацию хлорида калия в растворе, содержащем 0,053 кг КСl в 0,5 л раствора (r = 1,063 г/см3).
Решение. Масса раствора равна произведению объема раствора V на его плотность r. Процентная концентрация хлорида калия в растворе
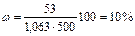 .
.
Пример 2. Какова масса NaOH, содержащегося в 0,2 л раствора, если молярная концентрация раствора 0,2 моль/л?
Решение. Масса NaOH, содержащегося в растворе
М naOH = 40 г/моль.
m =M · V = 0,2 · 40 · 0,2 = 1,6 г.
Пример 3. Определите эквивалентную концентрацию хлорида железа (III), если в 0,3 л раствора содержится 32,44 г FeCl3.
Решение. Молярная масса эквивалента FeCl3:
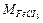 =162,5 г/моль.
=162,5 г/моль.
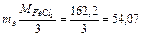 г/моль-экв.
г/моль-экв.
Молярная концентрация эквивалента раствора FeCl3:
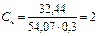 моль-экв/л.
моль-экв/л.
Пpимер 4. В какой массе воды надо растворить 4,0 г гидроксида натрия, чтобы получить раствор, моляльность которого равна 2,0 моль/кг?
Решение. Определяем число молей в 4 г NaOH:
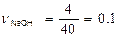 моль.
моль.
Массу растворителя (воды) находим из пропорции:
2 моль - 1000 г
0,1 моль - х г
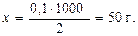
Пример 5. Какой объем раствора азотной кислоты с массовой долей 30% (r = 1,18 г/см3) требуется для приготовления 20 л 0,5 М раствора этой кислоты?
Решение. Сначала определяем массу азотной кислоты, содержащуюся в 20 л 0,5 М раствора:
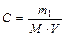 ;
;
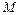 = 63 г/моль;
= 63 г/моль;
m1 = 0,5 · 63 · 20 = 630 г.
Далее надо определить, в каком объеме раствора с массовой долей азотной кислоты 30% содержится 630,1 г HNO3:
30 г - 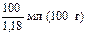
630 г х мл
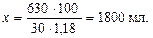
Следовательно, чтобы приготовить 20 л 0,5 М HNO3, надо израсходовать 1,8 л раствора азотной кислоты с массовой долей HNO3, равной 30%.
Пример 6. Определите концентрацию раствора КОН, если на нейтрализацию 0,035 л 0,3 н. HCI израсходовано 0,02 л раствора КОН.
Решение. Из закона эквивалентов следует, что количество эквивалентов всех веществ, участвующих в химической реакции, одинаково. В реакции участвует 0,035 ∙ 0,3 = 0,0105 эквивалента соляной кислоты. Для нейтрализации НСI потребуется такое же количество эквивалента КОН, т.е.
V KOH ∙ N KOH = V HCl ∙ N HCl
Отсюда 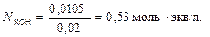
Вопросы для самоподготовки
1. Что называют раствором, растворенным веществом, растворителем?
2. Что называется концентрацией раствора? Способы количественного выражения концентрации растворов. Дайте определение.
3. Растворимость веществ (твердых, жидких, газов). Как изменяется растворимость веществ с повышением температуры?
4. Определите процентную концентрацию раствора, полученного при смешивании 300 г 10%-ного раствора и 200 г 20%-ного раствора NaOH.
5. Рассчитайте, сколько граммов карбоната натрия необходимо растворить в 2 дм3 воды для получения раствора с С = 0,5%?
6. Рассчитайте нормальную концентрацию раствора Fe(NO3)2, в 200 см3 которого содержится 9 г соли.
7. Определите молярность и нормальность 28%-ного раствора КОН (r = 1,263 г/см3).
8. Сколько литров NH3 (23°С, 94,95 кПа) необходимо растворить в 0,9 кг воды для приготовления 10%-ного раствора NH3?
9. К 250 г 12%-ного раствора нитрата серебра прибавили 300 см3 1М раствора хлорида натрия. Определите массу образовавшегося осадка.
10. Определите процентную концентрацию раствора, полученного при смешивании 200 г 10%-ного раствора НCI и 300 г воды.
ТЕСТЫ
1. Какая масса сульфата натрия содержится в 300 г 15%-го раствора соли?
а) 25;
б) 30;
в) 45;
г) 15.
2. Определите процентную концентрацию раствора, полученного при смешивании 300 г 20 %-го раствора с 200 г воды.
а) 12;
б) 10;
в) 24;
г) 16.
3. Какой объем 0,5 М раствора серной кислоты можно приготовить из 4,9 г кислоты?
а) 200 мл;
б) 100 мл;
в) 250 мл;
г) 400 мл.
4. Какая масса карбоната натрия необходима для приготовления 500 мл 1 н. раствора?
а) 10,3 г;
б) 26,5 г;
в) 20,8 г;
г) 1,04 г.
5. Какова нормальность 16%-го раствора гидроксида натрия
(р = 1,12 г/мл)?
а) 0,5 н;
б) 5,1 н;
в) 1,2 н;
г) 4,5 н.
5.Начала термодинамики
Термодинамика – наука о превращении одних видов энергии в другие. Энергия – это способность системы совершать работу. Видов энергии много (тепловая, ядерная, химическая), но существует два основных типа энергии: кинетическая и потенциальная.
Кинетическая энергия (Ек) – энергия движущегося тела, количественно определяется работой, которую может совершать тело, до достижения им покоя.
Потенциальная энергия (Еп) – определяется взаимным расположением частей тела в пространстве, это энергия химических связей в соединениях.
Химическая термодинамика изучает: энергетические эффекты различных процессов; переходы энергии из одной формы в другую, от одной части системы к другой; возможность и направление самопроизвольного протекания процессов.
Система – тело или группа тел, которое отделено от окружающей среды.
Фаза – часть системы, обладающая одинаковым химическим составом и одинаковыми термодинамическими параметрами.
Компоненты – вещества, которые составляют систему.
Параметры – свойства, которыми определяется система (P, V, T, m, C). От параметров зависят свойства системы.
Любая система может быть охарактеризована функциями состояния U, H, S, G. Функции состояния не зависят от пути перехода, а зависят от начального и конечного состояния системы.
Внутренняя энергия (U) – весь запас энергии системы, которая складывается из энергии движения молекул, электронов, кроме кинетической и потенциальной, [кДж, Дж].
Энтальпия ( Н)или теплосодержание – тепловой эффект образования одного моля сложного вещества из простых при стандартных условиях, [кДж/моль]. Для простых веществ
Н)или теплосодержание – тепловой эффект образования одного моля сложного вещества из простых при стандартных условиях, [кДж/моль]. Для простых веществ  Н = 0.
Н = 0.
Энтропия ( S)– мера неупорядоченности системы, [Дж/мольК]. Свободная энергиясистемы (энергия Гиббса (
S)– мера неупорядоченности системы, [Дж/мольК]. Свободная энергиясистемы (энергия Гиббса ( G) ) – изобарно-изотермический потенциал, определяет направление реакции, [кДж/моль].
G) ) – изобарно-изотермический потенциал, определяет направление реакции, [кДж/моль].
Для сравнения величин термодинамических функций состояния их измеряют в стандартных условиях (298 К, 101,325 кПа) и относят к 1 моль образующегося вещества.
При V = const – изохорный процесс (теплота, подведенная к системе расходуется на изменение внутренней энергии), P = const – изобарный (теплота, подведенная к системе расходуется на изменение теплового запаса энтальпии), t = const – изотермический процесс. Для изобарно-изотермического процесса о тепловом эффекте реакции можно судить по DН.
Физический смысл энтальпии – это внутреннее теплосодержание системы: реакции, идущие с выделением тепла – экзотермические, внутреннее теплосодержание системы уменьшается,  G > 0,
G > 0,  Н < 0; реакции, идущие с поглощением тепла из окружающей среды – эндотермические, внутреннее теплосодержание возрастает,
Н < 0; реакции, идущие с поглощением тепла из окружающей среды – эндотермические, внутреннее теплосодержание возрастает,  G < 0,
G < 0,  Н = – Q,
Н = – Q,  Н > 0. Тепловой эффект реакции – изменение энергии системы при переходе определенного числа моль исходных веществ в соответствующее число продуктов реакции.
Н > 0. Тепловой эффект реакции – изменение энергии системы при переходе определенного числа моль исходных веществ в соответствующее число продуктов реакции.
В 1840 г. Гесссформулировал основной закон термодинамики: тепловой эффект реакции при постоянном объеме и давлении зависит от начального и конечного состояния системы и не зависит от того каким образом система перешла из начального в конечное состояние.
C + O2 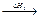 CO2; C + 1/2O2
CO2; C + 1/2O2 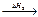 CO + 1/2O2
CO + 1/2O2 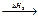 CO2
CO2
 Н1 =
Н1 =  Н2 +
Н2 +  Н3
Н3
В термохимических расчетах применяют следствие из закона Гесса:
тепловой эффект химической реакции  Н х.р равен сумме теплот образования
Н х.р равен сумме теплот образования  Н обр продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции.
Н обр продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции.
 Н ох.р = S
Н ох.р = S  Н прод. обр - S
Н прод. обр - S  Н исх. вещ
Н исх. вещ
Уравнения с указанием агрегатного состояния исходных веществ, продуктов реакции и указанием теплового эффекта реакции называются термохимическими; коэффициенты в них могут быть дробными.
Согласно закону Гесса термохимические уравнения можно складывать, вычитать, умножать на целые числа.
При  Н о < 0 реакции идут самопроизвольно, но тепловой эффект реакции не всегда является критерием самопроизвольного течения той или иной реакции.
Н о < 0 реакции идут самопроизвольно, но тепловой эффект реакции не всегда является критерием самопроизвольного течения той или иной реакции.
Самопроизвольно могут протекать не только те химические реакции, которые сопровождаются выделением теплоты (принцип Бертло-Томсена), но и реакции, сопровождающиеся поглощением теплоты.
Энтропия - мера неупорядоченности системы. Энтропия (как и внутренняя энергия, энтальпия, объем) пропорциональна количеству вещества и возрастает с увеличением скорости частиц, т.е. при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы конденсации, кристаллизации, сжатия, упрочения связей, полимеризации, связанные с упорядоченностью системы, ведут к уменьшению энтропии.
В любом произвольном процессе, реакция идет с увеличением энтропии, S – степень свободы частиц, свобода их перемещения. При уменьшении объема газа S уменьшается. С увеличением температуры S сильно возрастает. Стандартная энтропия S0 характеризует процесс образования 1 моль сложного вещества из простых веществ.
Согласно третьему закону термодинамики: энтропия чистых веществ, существующих в виде идеальных кристаллов, при абсолютном нуле равна нулю:
 S х.р = S S прод - S S исх
S х.р = S S прод - S S исх
Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка 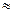 Т
Т  S. Таким образом, движущая сила процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку (TS).
S. Таким образом, движущая сила процесса складывается из двух сил: стремления к упорядочению (Н) и стремления к беспорядку (TS).
В химических процессах одновременно действуют две тенденции:
· стремление к образованию новых химических связей ведет к уменьшению энергии и энтальпии системы (энтальпийный фактор);
· стремление к разрыву старых химических связей ведет к возрастанию энтропии (энтропийный фактор). Сравнение двух тенденций отражает энергия Гиббса.
Мерой химического сродства является уменьшение  G, которая зависит от природы вещества, его количества, температуры и является функцией состояния, т.е.
G, которая зависит от природы вещества, его количества, температуры и является функцией состояния, т.е.
 G х.р = S
G х.р = S  G прод - S
G прод - S  G исх.
G исх.
При P = const и Т = const общую движущую силу процесса 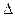 G можно найти из соотношения:
G можно найти из соотношения:
 Gх.р. = (H2 – H1) – (TS2 – TS1)
Gх.р. = (H2 – H1) – (TS2 – TS1)
 G =
G =  H – T
H – T  S
S
При уменьшении  G0 процесс принципиально осуществим, а при
G0 процесс принципиально осуществим, а при  G0 > 0 он самопроизвольно протекать не может. Чем меньше
G0 > 0 он самопроизвольно протекать не может. Чем меньше  G, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором
G, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором  G = 0 и
G = 0 и  Н = Т
Н = Т  S.
S.
Из соотношения  G =
G =  Н - Т
Н - Т  S видно, что самопроизвольно могут протекать и эндотермические процессы, для которых
S видно, что самопроизвольно могут протекать и эндотермические процессы, для которых  Н > 0. Это возможно когда,
Н > 0. Это возможно когда,  S > 0 и |T
S > 0 и |T  S| > |
S| > |  H|. Тогда
H|. Тогда  G < 0. Экзотермические реакции (
G < 0. Экзотермические реакции ( Н < 0) самопроизвольно не протекают, если при
Н < 0) самопроизвольно не протекают, если при  S < 0 окажется, что
S < 0 окажется, что  G > 0.
G > 0.
 2015-05-13
2015-05-13 7101
7101
