Ряд напряжений составлен в соответствии с ростом величин стандартных потенциалов редокс-пар, составленных из металлов и их окисленных форм (ионов). Этот ряд характеризует активность металлов в электрохимических реакциях.
| К Na Ca Mg Al | Mn Zn Cr Fe Co Ni Sn Pb | H | Cu Ag Pt Au Ir Pd |
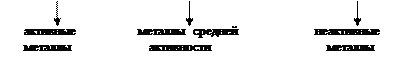
Растворение металлов в воде
Взаимодействие металлов с водой идет по реакции
Me + n H2O ® Me(OH) n + n /2H2
Потенциал водородного электрода при рН = 7 равен - 0,41 В. Металлы, для которых стандартный электродный потенциал Е0 < - 0,41В, вытесняют водород из воды. Таким образом, только самые активные щелочные и щелочноземельные металлы растворимы в воде.
Начиная с магния, активные металлы образуют малорастворимые оксидные пленки, покрывающие поверхность металла и предохраняющие его от дальнейшего окисления, этот процесс называют пассивацией.
Восстановление металлов
Активные металлы (с меньшим значением Е0) вытесняют менее активные (с большим значением Е0) из их соединений:
Zn + CuSO4®Cu + ZnSO4
Fe2O3 + 2Al®Al2O3 + 2Fe
 2015-05-13
2015-05-13 337
337








