Qp = - Qp` = Δ H; QV = - QV` = Δ U; (3.1)
Qp – QV = Δ ν . RT. (3.2)
Следствие из закона Гесса: тепловой эффект химической реакции равен алгеброической сумме тепловых эффектов образования продуктов реакции минус сумма тепловых эффектов исходных веществ с учетом стехиометрических коэффициентов:
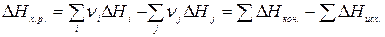 |
(3.3)
Или для реакции: а A + b B < = > c C + d D
Δ Hх.р. = (с .Δ HC0 + d .Δ HD0) – (a .Δ HA0 + b .Δ HB0). (3.4)
Стандартной энтальпией или теплотой образования (Δ H0обр., 298) называется тепловой эффект образования одного моля вещества из простых веществ в стандартных условиях (p = 101325 Па = 1 атм; Т = 250С = 298 К), при этом теплота образования простых веществ в стандартных условиях принимается равной нулю.
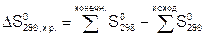 |
Изменение стандартных энтропий и свободных энергий образования химических реакций ΔS0298 и ΔG0298 вычисляют также с помощью следствия из закона Гесса:
(3.5)
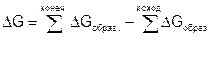 |
(3.6)
Основным уравнением химической термодинамики является уравнение Гиббса-Гельмгольца:
Δ G = ΔH - Т. ΔS, (3.7)
где Δ G -с вободная энергия Гиббса припостоянных температуре и давлении (изобарно-изотермический потенциал). Уравнение Гиббса-Гельмгольца определяет направление физических и химических процессов: в природе самопроизвольно протекают без затраты работы только те процессы, которые сопровождаются уменьшением свободной энергии системы – свободной энергии Гиббса (принцип минимума свободной энергии): ΔG < 0. Если ΔG = 0, то система находится в состоянии термодинамического равновесия.
ΔG0298 = - RT. ln K = - 2.3 RT. lg K = - 2.3 . 8.31. 298. lg K = - 5.69 . lg K.
.
 2015-05-13
2015-05-13 517
517








