1. Броматометрия - титрант, среда, индикаторы.
2. Определение точки эквивалентности.
3. Уравнения реакций.
4. Применение в фармацевтическом анализе.
Методы бромирования применяются для количественного определения ароматических соединений, особенно аминов и фенолов.
Раствор брома неустойчив, быстро меняет концентрацию, поэтому нельзя применять его в качестве титранта.
При использовании метода бромирования в качестве титрованного аствора применяется раствор бромата калия. Этот раствор можно готовить по точной навеске и он не меняет свой титр в течение длительного времени {около 6 месяцев). Бромат калия, являясь окислителем, в кислой среде восстанавливается до бромида:
ВгОз- + 6Н+ + 6е→ Вг- +ЗН2О.
Из схемы восстановления брома видно, что фактор эквивалентности бромата калия равна 1/6. Эквивалентная молярная масса его МЭKBrOз = 167,001:6 = 27,833 г/моль. Если надо проверить титр раствора бромата калия, применяют метод иодометрии.
Добавляют к подкисленному раствору бромата иодид калия, при этом выделяется свободный йод:
|
|
|
КВгОз + 6КI + 6НС1 = КВг + 3I2 + 6КСl + ЗН2О.
Выделившийся йод титруют тиосульфатом натрия
При титровании раствором бромата калия фиксирование точки эквивалентности производят следующим образом. Ионы ВrOз- в процессе титрования восстанавливаются в ионы Вг- Когда титрование окончено, избыток бромата (лишняя капля) вступает в реакцию с ионами ВГ-, при этом выделяется бром:
ВгОз- + 5Вг- + 6Н+ = ЗВr2 + ЗН2О.
Свободный, непрореагировавший, бром можно заметить по появлению желтой окраски.
При хорошем освещении и достаточной концентрации бромата калия титрование можно проводить без индикатора. Однако точку эквивалентности достаточно точно фиксировать нельзя.
Для повышения четкости и точности определения конца титрования применяют специальные необратимые индикаторы (азокрасители) метиловый оранжевый и метиловый красный. В точке эквивалентности выделившийся свободный бром разрушает индикатор и раствор обесцвечивается. Окраска индикатора не восстанавливается, так как окисление этих индикаторов необратимо. Окраска может исчезнуть раньше достижения точки эквивалентности, особенно если слишком быстро добавлять бромат. Поэтому к концу титрования рекомендуется добавлять еще несколько капель индикатора.
Титрованный раствор бромата калия применяется не только как титрант, но и как составная часть бромат-бромидной смеси (смесь с КВг), используемой для анализа многих органических соединений методом бромирования. Реакция бромирования идет с требуемой скоростью при подкислении раствора и добавлении избытка бромат-бромидной смеси.
Прибавление отмеренного количества точно приготовленного раствора бромата приводит к образованиюэ квивалентного количества брома:
|
|
|
КВrOз + 5КВг + 6HCI = ЗВr2 + 6KCI + ЗН2О
Свободный бром в момент выделения бромирует органические соединения, находящиеся в определяемом растворе.
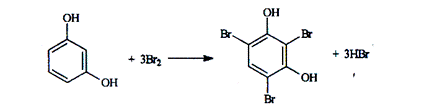
В методах бромирования используют прямое, косвенное (титрование заместителя) и обратное титрование. Например, при определении фенола применяется прямое титрование. К испытуемому раствору добавляют бромид калия и хлороводородную кислоту и титруют броматом калия. Весь выделившийся бром будет вступать в реакцию с фенолом.
Метод бромирования можно использовать при косвенном анализе многих металлов: магния, алюминия, меди, кадмия, цинка, применяя 8-оксихинолин. Определяемый металл сначала осаждают 8-оксихинолином. Отфильтрованный и промытый осадок растворяют в хлороводородной кислоте и титруют раствором бромата в присутствии бромида калия.
В фармацевтическом анализе метод бромирования часто применяют в сочетании с методом иодометрии; способ «титрование заместителя» дает возможность связать эти методы. Их используют при количественном определении салициловой кислоты и ее солей, некоторых сульфаниламидных препаратов, тимола, резорцина, стрептоцида.
Количественные определения, проводимые этим способом, основаны на реакциях бромирования органических соединений и иодометрическом определении не вошедшего в реакцию брома.
При определении протекают четыре химические реакции:
1. Реакция взаимодействия бромида калия с броматом калия в кислой среде:
КВгОз + 5КВг + 6НСl= ЗВr2 + 6KCl + ЗН2О.
2. Реакция бромирования органического соединения.
Рассмотрим эту реакцию на примере взаимодействия резорцина с бромом.

Так как титрованный раствор КВгОз прибавляется в избытке со стрептоцидом реагирует только эквивалентное ему количество брома - часть же брома остается в растворе.
3. Реакция взаимодействия избытка брома с иодидом калия:
2KI + Br2 → 2КВг + I2
Эта реакция происходит после добавления к определяемому раствору иодида калия.
4. Выделившийся йод титруют раствором тиосульфата натрия.
При количественном определении этим методом добавляется хлороформ, что способствует более точному и четкому определению конца титрования.
 2014-02-02
2014-02-02 25885
25885








