Лекция № 11
Механическая и термическая устойчивость вещества
В термодинамике фазой называется совокупность однородных, одинаковых по своим свойствам, частей системы. При определенных условиях разные фазы одного и того же вещества могут находиться в равновесии друг с другом, соприкасаясь между собой. Равновесие более чем трех фаз одного и того же вещества невозможно.
Переход из одной фазы в другую обычно сопровождается поглощением или выделением некоторого количества тепла, которое называется теплотой перехода.
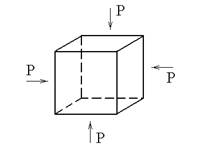 Условие механической устойчивости вещества
Условие механической устойчивости вещества
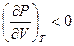
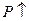 ,
, 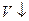 и наоборот -
и наоборот - 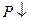 ,
, 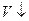 (где P – давление, V- объем).
(где P – давление, V- объем).
Условие термической устойчивости вещества
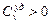
Перенос тепла осуществляется от более нагретого тела к менее нагретому (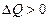 ). Сопровождается это понижением температуры. Следовательно,
). Сопровождается это понижением температуры. Следовательно, 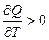 . Иной перенос тепла невозможен. Это условие выполняется всегда.
. Иной перенос тепла невозможен. Это условие выполняется всегда.
Удельные теплоты фазовых переходов
В жидких и твердых телах всегда имеется некоторое количество молекул, энергия которых оказывается достаточной, чтобы покинуть поверхность тела и перейти в газообразную фазу.
|
|
|
Переход жидкости в газообразное состояниеназывается испарением, переход твердого тела в газообразное состояние называется сублимацией.
При испарении и сублимации тело покидают наиболее быстрые молекулы, средняя энергия оставшихся молекул уменьшается и тело охлаждается. Переход жидкости в пар сопровождается поглощением тепла.
Тепло, которое надо сообщить единице массы вещества, чтобы перевести его в другое фазовое состояние, называется удельной теплотой фазового перехода.
При испарении жидкости молекулы совершают работу против сил, действующих в поверхностном слое толщиной r
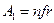 ,
,
где f - средняя величина силы;
n – число молекул в единице массы.
Кроме этого, совершается работа, связанная с увеличением объема вещества
 ,
,
где VП - удельный объем пара;
VЖ - удельный объем жидкости.
А1 и А2 совершаются за счет теплоты испарения q.
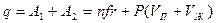 .
.
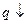 с ростом Т. Следовательно
с ростом Т. Следовательно 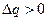 .
. 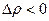 , плотность молекул пара меньше, чем жидкости.
, плотность молекул пара меньше, чем жидкости.
Наряду с испарением протекает и обратный переход из газообразной фазы в жидкую, называемый конденсацией.
Конденсация жидкости увеличивается по мере возрастания плотности молекул в пространстве над жидкостью, т.е. 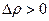 . При достижении некоторого Р количество молекул, покидающих жидкость равно количеству молекул, возвращающихся в жидкость. Плотность пара не изменяется
. При достижении некоторого Р количество молекул, покидающих жидкость равно количеству молекул, возвращающихся в жидкость. Плотность пара не изменяется 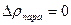 ,
, 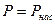 , где Рнас – давление насыщения.
, где Рнас – давление насыщения.
ü В открытом сосуде испарение происходит тем быстрее, чем больше площадь открытой поверхности.
ü В закрытом сосуде интенсивность испарения тем больше, чем дальше от состояния насыщения пар над поверхностью жидкости.
|
|
|
При конденсации 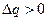 и
и 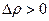 . Переход сопровождается выделением тепла. Плотность жидкости больше, чем плотность пара.
. Переход сопровождается выделением тепла. Плотность жидкости больше, чем плотность пара.
Все сказанное о равновесии между жидкостью и газом справедливо и для системы твердое тело-газ.
Переход вещества из твердого состояния в жидкое называется плавлением, а обратный переход – отвердеванием. Процесс плавления происходит с поглощением энергии и требует затраты некоторого количества тепла, которое называют теплотой плавления. Следовательно, 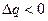 и
и  .
.
При сообщении веществу тепла его температура Т растет в зависимости от времени по следующему закону.
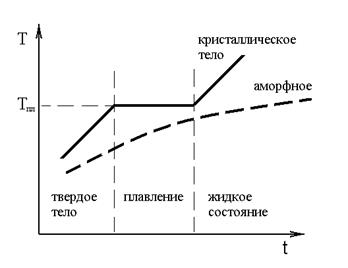 Между жидкой и твердой фазой осуществляется непрерывный теплообмен, приводящий к вы-равниванию температур. Вещество в твердом состоянии не может существовать при Т > Тпл, поэтому,пока все твердое тело не перейдет в жидкость его Т = Тпл.
Между жидкой и твердой фазой осуществляется непрерывный теплообмен, приводящий к вы-равниванию температур. Вещество в твердом состоянии не может существовать при Т > Тпл, поэтому,пока все твердое тело не перейдет в жидкость его Т = Тпл.
Подводимое количество теплоты идет на выполнение работы по разрушению кристаллической решет-ки, т.е. на увеличение Wпот молекул вещества.
Величина, измеряемая количеством теплоты, необходимым для плавления единицы массы твердого тела при Т = Тпл, называется удельной теплотой плавления 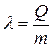 .
.
Некоторые вещества могут находиться в так называемом аморфном состоянии, имеющем структуру ближнего порядка, но не обладающем основным свойством жидкости – текучестью.
При увеличении температуры эти вещества стремятся к жидкостям, и  (происходит поглощение тепла).
(происходит поглощение тепла).
Кристаллизация происходит при той же температуре, что и плавление. При расчете количества теплоты, выделившегося при кристаллизации, также пользуются формулой
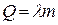 .
.
При охлаждении жидкости до температуры, когда фазы жидкого и твердого тела уравновешивают друг друга, начинается одновременный рост кристалликов вокруг зародышей или центров кристаллизации.
Центрами кристаллизации могут служить взвешенные в жидкости твердые частицы.
Процесс кристаллизации сопровождается выделением такого же количества тепла, какое поглощается при плавлении. 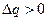
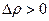 , т.к. плотность твердого тела больше, чем жидкости.
, т.к. плотность твердого тела больше, чем жидкости.
Существуют переходы из одной кристаллической модификации в другую, которые не связаны с поглощением или выделением тепла. Они называются фазовыми переходами второго рода. Для них 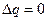 ,
, 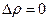 .
.
Все сказанное выше можно свести в таблицу:
| Фазовые переходы | Процессы | Изменения | |
| теплоты | плотности | ||
| І рода | Испарение Конденсация | 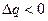
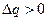
| 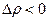
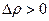
|
| І рода | Плавление Кристаллизация | 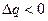
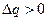
| 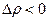
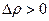
|
| ІІ рода | Структурные превращения | 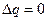
| 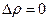
|
Уравнение Клапейрона – Клаузиуса
Рассмотрим цикл Карно для системы, состоящей из двух фаз единичной массы, находящихся в равновесии (например, жидкость и газ). Будем считать, что температуры нагревателя и холодильника отличаются на очень малую величину dТ.
Процесс перехода из 1 в 2 изотермический. Для осуществления фазового перехода нужно отобрать у вещества количество тепла l (для единицы массы вещества l = Dq). Это количество теплоты соответствует теплу, получаемому за цикл от нагревателя Q1

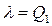 .
.
1 и 2 – однофазное состояние;
промежутки между 1 и 2 – двухфазное.
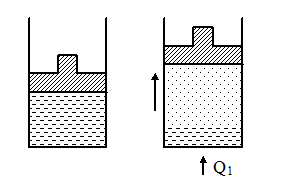 При сообщении системе тепла Q1 жидкость будет испаряться, и совершать работу, например, поднимая поршень. Когда испариться единица массы жидкости, уберем тепловой контакт и заставим систему расширяться по короткой адиабате 2-3 до тех пор, пока температура системы не будет равна температуре холодильника. Из состояния 3 вернем систему по изотерме 3-4 и адиабате 4-1 в исходное состояние 1, т.е. совершим цикл Карно.
При сообщении системе тепла Q1 жидкость будет испаряться, и совершать работу, например, поднимая поршень. Когда испариться единица массы жидкости, уберем тепловой контакт и заставим систему расширяться по короткой адиабате 2-3 до тех пор, пока температура системы не будет равна температуре холодильника. Из состояния 3 вернем систему по изотерме 3-4 и адиабате 4-1 в исходное состояние 1, т.е. совершим цикл Карно.
Работа, совершаемая за цикл, будет равна площади заштрихованной фигуры

 .
.
По определению К.П.Д. цикла Карно 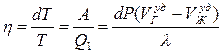 .
.
Откуда 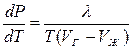 - уравнение Клапейрона-Клаузиуса.
- уравнение Клапейрона-Клаузиуса.
Это уравнение связывает производную от равновесного давления по температуре с теплотой перехода, температурой и разностью удельных объемов фаз, находящихся в равновесии. Уравнение Клапейрона-Клаузиуса справедливо не только для испарения, но и для других фазовых превращений, связанных с выделением или поглощением теплоты.
|
|
|
В случае плавления, например, можно записать
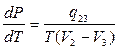 ,
,
где q23 – удельная теплота плавления;
V2 и V3 – удельные объемы жидкой и твердой фазы;
Т – температура плавления.
Если V2 > V3 , то 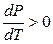 . С повышением давления точка плавления возрастает.
. С повышением давления точка плавления возрастает.
Если V2 < V3 , то 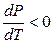 . С повышением давления температура плавления понижается.
. С повышением давления температура плавления понижается.
Так для воды V3 -V2 = 9,1*10-2 см3 /г; Т= 273°К; q=80 кал/г; dP/dT=134атм/К. Значит, что с увеличением давления на одну атмосферу Тпл льда понижается на 0,0075градуса.
Диаграмма фазовых переходов
А)
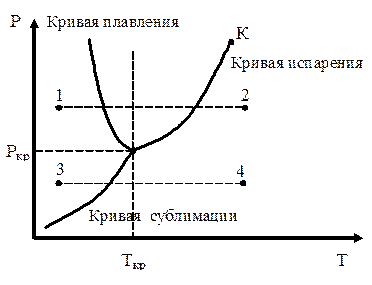 Рассмотрим состояние сис-темы, в которой число фаз, находящихся в равновесии друг с другом, равно трем. Примером такой системы может служить система твердое тело → жидкость → пар.
Рассмотрим состояние сис-темы, в которой число фаз, находящихся в равновесии друг с другом, равно трем. Примером такой системы может служить система твердое тело → жидкость → пар.
Возьмем сначала систему жидкость → пар, и будем от-нимать у нее тепло (охлаждать).
Точка, изображающая сос-тояние системы, будет пере-мещаться вниз по кривой испарения, пока не достигнет значения Ткр . Здесь будет кристаллизация. Эта температура и соответствующее ей значение Ркр будут единственной точкой, где существуют одновременно три состояния вещества: жидкое, твердое и газообразное. Она называется тройной точкой.
Б)
 Если продолжать отнимать тепло (охлаждать тело), то точка, изображающая состояние системы, переместится вниз по кривой сублимации.
Если продолжать отнимать тепло (охлаждать тело), то точка, изображающая состояние системы, переместится вниз по кривой сублимации.
В зависимости от соотношений между удельными объемами твердой и жидкой фаз кривая плавления будет иметь либо вид  , показанный на предыдущем рисунке, либо будет выглядеть так
, показанный на предыдущем рисунке, либо будет выглядеть так 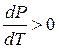 :
:
Все три кривые разбивают координатную плоскость на три области жидкость – газ - твердое тело.
Каждая точка такой области соответствует определенному равновесному состоянию вещества, поэтому ее называют диаграммой состояния.
Для веществ с несколькими кристаллическими модификациями диаграмма состояния имеет более сложный вид.
|
|
|
В)
 Здесь число кристаллических состояний равно двум (имеем две тройные точки Тр и Тр'.
Здесь число кристаллических состояний равно двум (имеем две тройные точки Тр и Тр'.
Зная диаграмму состояния можно предсказать, в каком состоянии будет вещество при различных условиях, а также, какие превращения оно будет претерпевать при различных процессах.
Пример
Переход 1-2: изобарическое нагревание кристалл→жидкость→газ;
Переход 3-4: изобарическое нагревание кристалл→газ.
У большинства веществ тройная точка лежит ниже атмосферного давления. Поэтому переход из твердого состояния в газообразное осуществляется через промежуточную – жидкую – фазу. Но могут быть и другие переходы.
Для углекислоты давление тройной точки Р=5,11 атм. Поэтому при атмосферном давлении она может существовать только в твердом (точка 3) и газообразном (точка 4) состоянии.
Если удельный объем кристаллов превосходит удельный объем жидкой фазы, то, пользуясь диаграммой (б), переход из 5 в 6 будет проходить через состояния газ → кристалл → жидкое состояние. Отметим еще одну особенность диаграммы состояния: кривая испарения заканчивается в критической точке К. Поэтому возможен переход из жидкого состояния в газообразное в обход критической точки без пересечения кривой испарения. Этот переход совершается непрерывно через последовательность однофазных состояний, у которых отсутствует анизотропия.
Анизотропия изменяется только скачком (либо она есть, либо ее нет). Поэтому кривая плавления уходит в бесконечность, а кривая сублимации – в точку Р=0, Т=0
 2015-07-04
2015-07-04 2396
2396