Определение отношения теплоемкостей воздуха при постоянном давлении и объеме
Методические указания к лабораторной работе № 2.7
Лабораторная работа №27
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ВОЗДУХА
ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ОБЪЕМЕ
Цель работы – изучение процессов в идеальных газах, определение отношения теплоемкостей 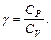
Теория метода
Удельной теплоемкостью вещества называется величина, равная количеству теплоты, которую необходимо сообщить единице массы вещества для увеличения ее температуры на один Кельвин:
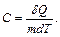 (6.1)
(6.1)
Теплоемкость одного моля вещества называется молярной теплоемкостью:
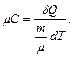 (6.2)
(6.2)
где m – масса, μ – молярная масса вещества.
Значение теплоемкости газов зависит от условий их нагревания. Согласно с первым законом термодинамики количество теплоты δQ, сообщенное системе, расходуется на увеличение внутренней энергии dU и на выполнение системой работы δА против внешних сил:
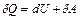 (6.3)
(6.3)
Увеличение внутренней энергии идеального газа в случае изменения его температуры на dT:
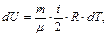 (6.4)
(6.4)
здесь i – число степеней свободы молекулы, под которым подразумевается число независимых координат, определяющих положение молекулы в пространстве: i=3 – для одноатомной; i=5 – для двухатомной; i= 6 – для трех- и многоатомной, R – универсальная газовая постоянная; R=8,31 Дж/(моль·К).
При расширении газа система выполняет работу
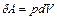 (6.5)
(6.5)
Если газ нагревать при постоянном объеме V=const, то δА=0 и согласно с (6.3) все полученное газом количество теплоты расходуется только на увеличение его внутренней энергии δQV=dU и, учитывая (6.4), молярная теплоемкость идеального газа при постоянном объёме
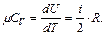 (6.6)
(6.6)
Если газ нагревать при постоянном давлении P=const, то полученное газом количество теплоты расходуется на увеличение внутренней энергии dU и выполнение работы δА
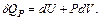
Тогда молярная теплоемкость идеального газа при постоянном давлении
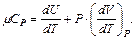 (6.7)
(6.7)
Используя уравнение состояния идеального газа (уравнение Клапейрона-Менделеева)
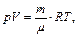
можно доказать, что для моля газа
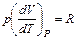
и, поэтому
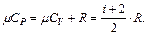 (6.8)
(6.8)
Отношение теплоемкостей:
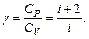 (6.9)
(6.9)
Адиабатным называется процесс, протекающий без теплообмена с окружающей средой, δQ=0.
На практике он может быть осуществлен в системе, окруженной теплоизоляционной оболочкой, но поскольку для теплообмена необходимо некоторое время, то адиабатным можно считать также процесс, который протекает так быстро, что система не успевает вступить в теплообмен с окружающей средой. Первый закон термодинамики с учетом (6.4)-(6.6) для адиабатного процесса имеет вид
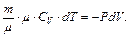 (6.10)
(6.10)
Продифференцировав уравнение Клапейрона-Менделеева
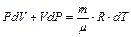
и подставляя dT в формулу (6.10), получим
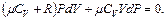
Учитывая соотношение между молярными теплоемкостями идеального газа при постоянном давлении и объеме, которое описывается формулой Майера (6.8), а также (6.9), получим
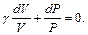
Решение написанного дифференциального уравнения имеет вид
PVγ=const (6.11)
Уравнение (6.11) называется уравнением адиабаты (уравнением Пуассона), а введенная в (6.9) величина γ – показателем адиабаты.
Метод определения показателя адиабаты, предложенный Клеманом и Дезормом (1819 г.), основывается на изучении параметров некоторой массы газа, переходящей из одного состояния в другое двумя последовательными процессами – адиабатным и изохорным. Эти процессы на диаграмме Р – V (рис. 6.1) изображены кривыми соответственно 1-2 и 2-3. Если в баллон, соединенный с открытым водяным манометром, накачать воздух и подождать до установления теплового равновесия с окружающей средой, то в этом начальном состоянии 1 газ имеет параметры P1, V1, Т1, причем температура газа в баллоне равна температуре окружающей среды T1=T0, а давление Р1=Р0+Р1 немного больше атмосферного.
|
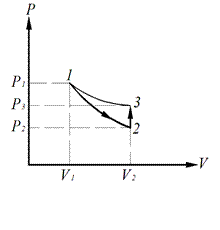 Если теперь на короткое время соединить баллон с атмосферой, то произойдет адиабатное расширение воздуха. При этом воздух в баллоне перейдет в состояние 2, его давление понизится до атмосферного Р2=Р0. Масса воздуха, оставшегося в баллоне, которая в состоянии 1 занимала часть объема баллона, расширяясь, займет весь объем V2. При этом температура воздуха, оставшегося в баллоне, понизится до T2. Поскольку процесс 1-2 – адиабатный, к нему можно применить уравнение Пуассона (6.11):
Если теперь на короткое время соединить баллон с атмосферой, то произойдет адиабатное расширение воздуха. При этом воздух в баллоне перейдет в состояние 2, его давление понизится до атмосферного Р2=Р0. Масса воздуха, оставшегося в баллоне, которая в состоянии 1 занимала часть объема баллона, расширяясь, займет весь объем V2. При этом температура воздуха, оставшегося в баллоне, понизится до T2. Поскольку процесс 1-2 – адиабатный, к нему можно применить уравнение Пуассона (6.11):
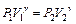 или
или 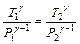 .
.
Отсюда
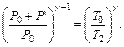 (6.12)
(6.12)
После кратковременного соединения баллона с атмосферой охлажденный из-за адиабатного расширения воздух в баллоне будет нагреваться (процесс 2-3) до температуры окружающей среды Т3=Т0 при постоянном объеме V3=V2. При этом давление в баллоне поднимется до Р3=Р2+Р.
Поскольку процесс 2-3 – изохорный, к нему можно применить закон Шарля:
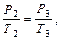
Отсюда
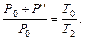 (6.13)
(6.13)
Из уравнений (6.12) и (6.13) получим:
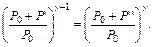
Прологарифмируем:
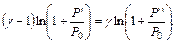
Поскольку избыточные давления Р' и Р" очень малы по сравнению с атмосферным давлением Р0 и учитывая что при х<<1 ln(1+х)≈х, будем иметь
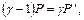
Откуда
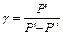 . (6.14)
. (6.14)
Избыточные давления Р' и Р" измеряют с помощью U-образного манометра по разности уровней жидкости с плотностью ρ:
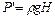 ;
; 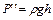 . (6.15)
. (6.15)
Из (6.14) и (6.15) получим расчетную формулу для определения γ:
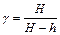 (6.16)
(6.16)
Экспериментальная установка
Для определения отношения теплоемкостей воздуха 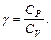 предназначена экспериментальная установка ФПТ1-6, общий вид которой показан на рисунке 6.2.
предназначена экспериментальная установка ФПТ1-6, общий вид которой показан на рисунке 6.2.
Установка состоит из стеклянной колбы, соединенной с открытым водяным манометром 2. Воздух нагнетается в колбу микрокомпрессором, размещенным в блоке приборов 2. Микрокомпрессор включается тумблером "Воздух", установленным на передней панели блока приборов 4. Пневмотумблер "Атмосфера" 5, расположенный на панели блока приборного, позволяет при повороте его по часовой стрелке до щелчка соединить колбу с атмосферой.
Порядок выполнения работы
1. Включить установку тумблером "Сеть".
2. Для подачи воздуха в колбу включить тумблер "Воздух".
3. С помощью манометра контролируют давление в колбе. Когда разность уровней воды в манометре достигнет 150...250 мм вод. ст., отключить подачу воздуха.
4. Подождать 2...3 мин., пока температура воздуха в колбе сравняется с температурой окружающего воздуха Т0, в колбе при этом установится постоянное давление 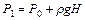 . Определить разность уровней Н, установившуюся в коленах манометра, и полученное значение занести в таблицу 6.1.
. Определить разность уровней Н, установившуюся в коленах манометра, и полученное значение занести в таблицу 6.1.
Таблица 6.1
| № изм. | Н, мм вод. ст. | h, мм вод. ст. | γ |
5. На короткое время соединить колбу с атмосферой, повернув пневмотумблер "Атмосфера" по часовой стрелке до щелчка.
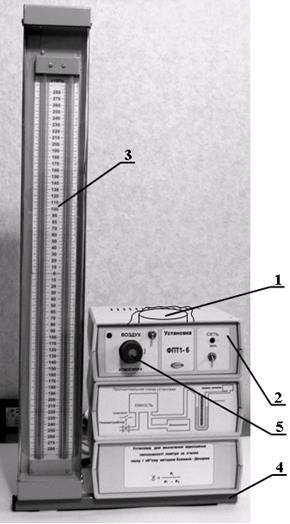
Рисунок 6.2 Общий вид экспериментальной установки ФПТ1-6
1 – колба; 2 – блок приборов; 3 – блок манометра;
4 – стойка; 5 – пневмотумблер "Атмосфера".
6. Через 2...3 мин., когда в колбе установится постоянное давление 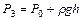 , определить разность уровней h, установившуюся в коленах манометра, и полученное значение занести в таблицу 6.1.
, определить разность уровней h, установившуюся в коленах манометра, и полученное значение занести в таблицу 6.1.
7. Повторить измерения по пп. 2-6 не менее 10 раз при различных значениях величины Н.
8. Выключить установку тумблером "Сеть".
Обработка результатов измерения
1. Для каждого измерения определить по формуле (6.16) отношение теплоемкостей γ. Найти среднее значение  .
.
2. Оценить погрешность результатов измерения.
Контрольные задания
1. Что такое изопроцессы и каким законам они подчиняются? Нарисуйте графики этих процессов.
2. Сформулируйте 1 закон термодинамики. Запишите этот закон для изобарного, изохорного, изотермического и адиабатного процессов.
3. Дайте определение удельной и молярной теплоемкости. В каких единицах СИ они измеряются?
4. В чем особенности теплоемкости газа? Выведите формулу для молярных теплоемкостей μСV и μCP идеального газа.
5. Дайте определение числа степеней свободы молекулы. Чему равна величина i для 1-, 2-, 3- и многоатомного идеальных газов?
6. Какой процесс называется адиабатным? Выведите уравнение Пуассона.
7. Рассчитайте теоретическое значение показателя адиабаты для 1-,2- и 3-атомного идеального газа.
8. В чем заключается метод Клемана и Дезорма для определения отношения 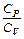 ?
?
9. Опишите рабочий цикл экспериментальной установки no P-V диаграмме.
10. Выведите расчетную формулу для определения γ.
11. Как и почему изменяется температура газа в колбе при проведении опыта?
 2015-05-10
2015-05-10 6645
6645