1. Общая, активная, потенциальная кислотность (щелочность) характерна для:
1) сильных электролитов
2) слабых электролитов
3) гидролизующихся солей
4) неэлектролитов
2. рН буферного раствора при добавлении сильных кислот, щелочей:
1) приблизительно сохраняется
2) резко возрастает
3) резко уменьшается
4) сначала увеличивается, а потом уменьшается
3. Найдите гемоглобиновую буферную систему:
1) HCOO-, HCOOH
2) HCO3-, H2CO3
3) Hb-, HHb, HbO2-, HHbO2
4) CH3COO-, CH3COOH
4. В плазме крови (рН=7,36 – 7,42) отсутствует:
1) белковый буфер
2) аммиачный буфер
3) фосфатный буфер
4) бикарбонатный буфер
5. При физиологическом значении рН=7,36 соотношение [ HCO3- ] / [ CO2 ] равно:
1) 20:1
2) 15:3
3) 10,7:1
4) 4:1
6. Найдите верную фразу:
1) буферная емкость не зависит от количества добавленного сильного электролита
2) максимальная буферная емкость при рН = рК слабого компонента системы
3) буферная емкость меняется только при добавлении сильной кислоты
4) буферная емкость – величина постоянная
7. При добавлении HCI к буферной системе NH4CI / NH4OH
1) конц. NH4CI уменьшается, конц. NH4OH увеличивается
2) конц. NH4CI увеличивается, конц. NH4OH уменьшается
3) увеличиваются обе конц.
4) конц. компонентов не меняются
8. При физиологическом значении рН=7,36 соотношение [ HPO42- ] / [ H2PO4- ] равно:
1) 20:1
2) 10:1
3) 16:3
4) 4:1
9. В каком объемном отношении смешали 0,1н растворы NH4CI и NH4OH (рК=4,76), если рН буферного раствора равно 9,24:
1) 1:2
2) 2:1
3) 1:1
4) 2:3
10. Щелочной резерв крови – это:
1) число мл СО2 в 100 мл крови
2) число мл NaOH при титровании
3) ацидоз
4) алкалоз
11. Какой вид имеет уравнение Гендерсона – Гассельбаха для бикарбонатной буферной системы в крови человека:
1) рН = рКа + lg 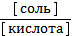
2) рН = 6,11 + lg 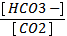
3) рН = 14 - рКосн - lg 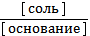
4) рОН = рКосн - lg 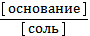
12. Буферное действие белков связано:
1) с их амфотерными свойствами
2) с образованием катионов
3) с образованием анионов
4) с образованием биполярного иона
13. Смешали 100мл 0,1н CH3COOH (рК = 4,76) и 100мл 0,1н CH3COONa рН раствора:
1) 5,36
2) 4,16
3) 4,76
4) 5,10
14. К фосфатной буферной системе прибавили щелочь:
1) конц. H2PO42- уменьшается, конц. HPO4- увеличивается
2) конц. H2PO42- увеличивается, конц. HPO4- уменьшается
3) конц. компонентов увеличиваются одинаково
4) обе конц. не меняются
15. Зона действия буферной системы – это:
1) рН > pKд слабого электролита
2) рН < pKд слабого электролита
3) рН = pKд ± 1
4) рН = pKд слабого электролита
16. Экстренная мера при ацидозе:
1) Na2SO4
2) 4,5 – 8,4%NaHCO3
3) NH4CH3COO
4) NH4CI
17. Кислотно–основное состояние организма связано главным образом с:
1) бикарбонатной буферной системой
2) фосфатной буферной системой
3) белковой буферной системой
4) аммиачной буферной системой
18. Фосфатная кислота может быть использована, чтобы получить:
1) 3 разных буферных растворов
2) только один буфер НРО42-, Н2РО4-
3) не дает буферных систем
4) только в смеси с уксусной и борной кислотами
19. При диабете в организме накапливается β – гидроксимасляная кислота и развивается:
1) метаболический алкалоз
2) респираторный алкалоз
4) респираторный ацидоз
20. Фермент карбоангидраза способствует:
1) выделению воды
2) связыванию протонов кислоты
3) связыванию основных компонентов
4) выделению СО2 через легкие
21. Что такое водородный показатель – рН:
1) конц. ионов водорода
3) – lgCH+
4) активность протонов
22. Буферный раствор состоит из:
1) двух кислот
2) двух сильных электролитов
3) двух оснований
4) слабого электролита и его соли
23. рН буферного раствора при разбавлении:
1) остается постоянным
2) изменяется мало
3) существенно меняется
4) сперва увеличивается, затем уменьшается
24. Найдите фосфатную буферную систему:
1) HCOO-, HCOOH
2) PO43-, HPO42-
3) HPO42-, H2PO4-
4) NO3-, HNO3
25. В эритроцитах (рН = 7,25) не находится:
1) гемоглобиновая буферная система
2) белковый буфер
3) бикарбонатный буфер
4) фосфатный буфер
26. К ацетатной буферной системе прибавили NaOH:
1) конц. СН3СООН уменьшается, конц. СН3СОО- увеличивается
2) конц. СН3СООН увеличивается, конц. СН3СОО- уменьшается
3) обе конц. уменьшаются
4) конц. компонентов не меняются
27. В бикарбонатном буфере избытку сильной кислоты противодействует:
1) соль NaHCO3
2) слабая кислота СО2 + Н2О
3) соль + слабая кислота
4) соль NaCI
28. При ацидозе рН плазмы крови смещается в область:
1) меньших значений
2) больших значений
3) рН не меняется
4) нейтрального рН
29. Гемоглобиновая буферная система действует:
1) в плазме крови
2) в плазме крови и во внутренней среде эритроцитов
3) во внутренней среде эритроцитов
4) во внеклеточной жидкости
30. К буферным системам относятся:
1) NaCH3COO / CH3COOH и NH4CI / NH4OH
2) NaHCO3 / H2CO3 и NaNO3 / HNO3
3) Na2HPO4 / NaH2PO4 и KCI / KOH
4) NH4CI / HCI и NH4CI / NaOH
31. К 500мл буферного раствора прибавили 20мл 0,1н HCI; ΔрН = 0,20. Буферная емкость по кислоте равна:
1) 0,004 моль-экв/л
2) 0,2 моль-экв/л
3) 0,02 моль-экв/л
4) 0,01 моль-экв/л
32. Белковая буферная система при рН < ИЭТ образуют пару:
1) H3N+-Pt – COO- и NH2 – Pt – COO-
2) H3N+ - Pt – COO- и H3N+ - Pt – COOH
3) H3N+ - Pt – COO- и H2N - Pt – COOH
4) H2N - Pt – COO- и H2N - Pt – COOH
33. При вдыхании чистого О2 парцианальное давление СО2 уменьшается, в легких развивается:
1) ацидоз
2) алкалоз
3) рН не меняется
4) дыхательный ацидоз
34. Буферная емкость бикарбонатного буфера в организме человека больше:
1) по основанию
2) по кислоте
3) одинакова по кислоте и по основанию
4) зависит от разбавления
35. К фосфатной буферной системе прибавили HCI:
1) конц. HPO42- увеличивается, конц. Н2РО4- уменьшается
2) конц. HPO42- уменьшается, конц. Н2РО4- увеличивается
3) обе конц. уменьшаются
4) конц. не меняются
36. Если слабая кислота двухосновна, то при нейтрализации ее щелочью можно получить:
1) только 1 вид буферного раствора
2) два разных буферных растворов
3) идет полная нейтрализация
4) образуется соль и вода
37. рН буферной системы не зависит от:
1) природы слабого компонента
2) соотношения компонентов системы
3) температуры
4) объема буферной системы
38. Для устранения алкалоза вводят:
1) 5% р-р аскорбиновой кислоты
2) соляную кислоту
4) ацетат аммония
39. Смещение рН крови в кислую область – это:
1) алкалоз
2) ацидоз
3) ацидиметрия
4) алкалиметрия
40. Увеличение щелочных продуктов в плазме крови концентрацию СО2:
1) увеличивает
2) уменьшает
3) не изменяет
4) сперва рост, потом уменьшение
41. Буферные растворы – это система:
1) равновесная система, поддерживающая постоянство рН при добавлении небольших количеств сильных кислот, щелочей и при разбавлении
2) изменяющая рН при добавлении сильных кислот
3) изменяющая рН при разбавлении
4) изменяющая рН при добавлении щелочей
42. рН буферного раствора, полученного смещением 0,1н NH4OH (рК=4,76) и 0,1н раствора NH4CI, равен:
1) 4,76
2) 9,24
3) 7,40
4) 10,20
43. В фосфатной буферной системе избытку щелочи противодействует:
1) NaH2PO4
2) Na2HPO4
3) слабое влияние щелочи
4) нет противодействия
44. Фосфатная буферная система действует в:
1) плазме крови
2) плазме крови и во внутренней среде эритроцитов
3) во внутренней среде эритроцитов
4) во внеклеточной жидкости
45. Формиатная буферная система приготовлена смешиванием 0,1 моль – экв НСООН (рК = 3,75) и HCOONa, pH раствора:
1) 3,75
2) 3,45
3) 4,05
4) 4,40
46. рН крови в норме:
1) 6,80 – 6,90
2) 7,90 – 8,02
3) 7,36 – 7,42
4) 7,52 – 7,82
47. Если рН буф р-ра > рКд слабого компонента, то система устойчива:
1) к избытку соли
2) к избытку щелочи
3) устанавливается равновесие
4) к избытку кислоты
48. При одинаковой концентрации компонентов буферной системы, буферная емкость:
1) возрастает и она максимальна
2) уменьшается
3) не зависит от концентрации компонентов системы
4) проходит через максимум и уменьшается
49. Какой анион HPO42- соли Н2РО4- принимает участие в нейтрализации протонов в почечной ткани:
1) Н2РО4-
2) HPO42-
3) оба аниона в одинаковой степени
4) анионы не принимают участие
50. К 1 литру буферного раствора прибавили 10мл 0,1н КОН; △рН = 0,10. Буферная емкость по основанию равна:
1) 1 моль/л
2) 0,01 моль – экв/л
3) 0,001 моль – экв/л
4) 0,1 моль – экв/л
51. Алкалоз – это смещение рН плазмы крови:
1) < 7,36
2) >7,36
3) рН=7,36
4) рН не меняется
52. Белковая буферная система действует в организме совместно с:
1) бикарбонатным буфером
2) фосфатным буфером
3) действует сама по себе
4) гемоглобиновой буферной системой
53. Какой буферный раствор – бикарбонатный или ацетатный – надо взять, если рН р-ра должен быть 6,00:
1) бикарбонатный
2) ацетатный
3) оба пригодны
4) оба не подходят
54. Если рН буф р-ра > рКд сл к-ты, что надо прибавить, чтобы рН стало равным рКд:
1) щелочь
2) соль
3) кислоту
4) воду
55. Фосфатная кислота может быть использована, чтобы получить:
1) 3 разных буферных растворов
2) только один буфер НРО42-, Н2РО4-
3) не дает буферных систем
4) только в смеси с уксусной и борной кислотами
56. Кислотно–основное состояние организма связано главным образом с:
1) бикарбонатной буферной системой
2) фосфатной буферной системой
3) белковой буферной системой
4) аммиачной буферной системой
57. Экстренная мера при ацидозе:
1) Na2SO4
2) 4,5 – 8,4 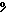 NaHCO3
NaHCO3
3) NH4CH3COO
4) NH4CI
58. Зона действия буферной системы – это:
1) рН > pKд слабого электролита
2) рН < pKд слабого электролита
3) рН = pKд ± 1
4) рН = pKд слабого электролита
59. К фосфатной буферной системе прибавили щелочь:
1) конц. H2PO42- уменьшается, конц. HPO4- увеличивается
2) конц. H2PO42- увеличивается, конц. HPO4- уменьшается
3) конц. компонентов увеличиваются одинаково
4) обе конц. не меняются
60. Смешали 100мл 0,1н CH3COOH (рК = 4,76) и 100мл 0,1н CH3COONa рН раствора:
1) 5,36
2) 4,16
3) 4,76
4) 5,10
61. Буферное действие белков связано:
1) с их амфотерными свойствами
2) с образованием катионов
3) с образованием анионов
4) с образованием биполярного иона
62. Какой вид имеет уравнение Гендерсона – Гассельбаха для бикарбонатной буферной системы в крови человека:
1) рН = рКа + lg 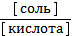
2) рН = 6,11 + lg 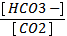
3) рН = 14 - рКосн - lg 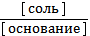
4) рОН = рКосн - lg 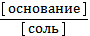
63. Щелочной резерв крови – это:
1) число мл СО2 в 100 мл крови
2) число мл NaOH при титровании
3) ацидоз
4) алкалоз
64. В каком объемном отношении смешали 0,1н растворы NH4CI и NH4OH (рК=4,76), если рН буферного раствора равно 9,24:
1) 1:2
2) 2:1
3) 1:1
4) 2:3
65. При физиологическом значении рН=7,36 соотношение [ HPO42- ] / [ H2PO4- ] равно:
1) 20:1
2) 10:1
3) 16:3
4) 4:1
66. При добавлении HCI к буферной системе NH4CI / NH4OH
1) конц. NH4CI уменьшается, конц. NH4OH увеличивается
2) конц. NH4CI увеличивается, конц. NH4OH уменьшается
3) увеличиваются обе конц.
4) конц. компонентов не меняются
67. Найдите верную фразу:
1) буферная емкость не зависит от количества добавленного сильного электролита
2) максимальная буферная емкость при рН = рК слабого компонента системы
3) буферная емкость меняется только при добавлении сильной кислоты
4) буферная емкость – величина постоянная
68. При физиологическом значении рН=7,36 соотношение [ HCO3- ] / [ CO2 ] равно:
1) 20:1
2) 15:3
3) 10,7:1
4) 4:1
69. В плазме крови (рН=7,36 – 7,42) отсутствует:
1) белковый буфер
2) аммиачный буфер
3) фосфатный буфер
4) бикарбонатный буфер
70. Найдите гемоглобиновую буферную систему:
1) HCOO-, HCOOH
2) HCO3-, H2CO3
3) Hb-, HHb, HbO2-, HHbO2
4) CH3COO-, CH3COOH
71. рН буферного раствора при добавлении сильных кислот, щелочей:
1) приблизительно сохраняется
2) резко возрастает
3) резко уменьшается
4) сначала увеличивается, а потом уменьшается
72. Общая, активная, потенциальная кислотность (щелочность) характерна для:
1) сильных электролитов
2) слабых электролитов
3) гидролизующихся солей
4) неэлектролитов
73. К 500мл буферного раствора прибавили 20мл 0,1н HCI; ΔрН = 0,20. Буферная емкость по кислоте равна:
1) 0,004 моль-экв/л
2) 0,2 моль-экв/л
3) 0,02 моль-экв/л
4) 0,01 моль-экв/л
74. К буферным системам относятся:
1) NaCH3COO / CH3COOH и NH4CI / NH4OH
2) NaHCO3 / H2CO3 и NaNO3 / HNO3
3) Na2HPO4 / NaH2PO4 и KCI / KOH
4) NH4CI / HCI и NH4CI / NaOH
75. Гемоглобиновая буферная система действует:
1) в плазме крови
2) в плазме крови и во внутренней среде эритроцитов
3) во внутренней среде эритроцитов
4) во внеклеточной жидкости
76. При ацидозе рН плазмы крови смещается в область:
1) меньших значений
2) больших значений
3) рН не меняется
4) нейтрального рН
77. В бикарбонатном буфере избытку сильной кислоты противодействует:
1) соль NaHCO3
2) слабая кислота СО2 + Н2О
3) соль + слабая кислота
4) соль NaCI
78. К ацетатной буферной системе прибавили NaOH:
1) конц. СН3СООН уменьшается, конц. СН3СОО- увеличивается
2) конц. СН3СООН увеличивается, конц. СН3СОО- уменьшается
3) обе конц. уменьшаются
4) конц. компонентов не меняются
79. В эритроцитах (рН = 7,25) не находится:
1) гемоглобиновая буферная система
2) белковый буфер
3) бикарбонатный буфер
4) фосфатный буфер
80. Найдите фосфатную буферную систему:
1) HCOO-, HCOOH
2) PO43-, HPO42-
3) HPO42-, H2PO4-
4) NO3-, HNO3
 2015-06-14
2015-06-14 4100
4100