Растворы некоторых веществ (кислот, щелочей, солей) в воде - электролиты - способны проводить электрический ток. В воде молекулы этих веществ распадаются (диссоциируют) на ионы вследствие того, что полярные молекулы воды ослабляют связь между ионами. Степень диссоциации очень сильно зависит от температуры. Наряду с диссоциацией наблюдается обратный процесс – рекомбинация (воссоединение) ионов. Обычно имеется динамическое равновесие, при котором число актов диссоциации равно числу актов рекомбинации. Количество ионов в единице объема электролита пропорционально n0 – числу молекул в единице объема: 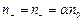 – концентрация положительных и отрицательных ионов одинаковы (предполагается, что молекулы диссоциируют на два иона), a - коэффициент диссоциации.
– концентрация положительных и отрицательных ионов одинаковы (предполагается, что молекулы диссоциируют на два иона), a - коэффициент диссоциации.
Число актов диссоциации в единицу времени пропорционально числу нераспавшихся молекул: 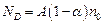 , а число актов рекомбинации за то же время пропорционально как числу положительных, так и числу отрицательных ионов:
, а число актов рекомбинации за то же время пропорционально как числу положительных, так и числу отрицательных ионов: 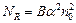 . Здесь А и В некоторые постоянные, зависящие от природы вещества и температуры. При условии равновесия
. Здесь А и В некоторые постоянные, зависящие от природы вещества и температуры. При условии равновесия 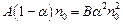 , или
, или
|
|
|
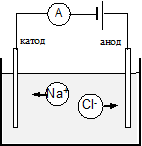 Рис. 7.1. Движение ионов в электролите
Рис. 7.1. Движение ионов в электролите
|
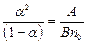 (7.5)
(7.5)
Выражение (7.5) называют законом Оствальда для электролитов. Из него следует, что при низкой концентрации раствора коэффиицент диссоциации близок к единице.
При наличии электрического поля между электродами отрицательные ионы движутся к аноду, а положительные - к катоду (рис. 7.1).
Противодействие, которое ионы, ускоряемые полем Е, встречают со стороны молекул растворителя, можно интерпретировать как трение, при этом можно считать, что движение ионов происходит с постоянной скоростью как в любой вязкой среде, а величина скорости u пропорциональна напряженности электрического поля Е. Действительно, если представить силу трения как 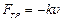 , где k – коэффициент вязкого трения, то при некоторой скорости результирующая сила станет равной нулю:
, где k – коэффициент вязкого трения, то при некоторой скорости результирующая сила станет равной нулю: 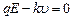 . Отсюда получаем установившуюся скорость
. Отсюда получаем установившуюся скорость 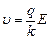 или
или 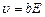 , где b – коэффициент пропорциональности (подвижность ионов).
, где b – коэффициент пропорциональности (подвижность ионов).
Плотность тока можно определить с помощью (7.1). Учтем только, что скорости положительных и отрицательных ионов могут различаться, поэтому в выражении для плотности тока их нужно записывать раздельно. Получаем:
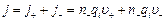 , где qi – заряд иона.
, где qi – заряд иона.
Как уже говорилось, концентрация положительных и отрицательных ионов одинакова: 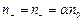 . Выразив скорость через напряженность поля и подвижность, получим:
. Выразив скорость через напряженность поля и подвижность, получим: 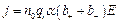 (7.6)
(7.6)
Плотность тока пропорциональна напряженности поля, следовательно, для электролитов, как и для металлов, справедлив закон Ома. Однако закон Ома для электролитов выполняется не при всех возможных значениях тока. При очень больших напряженностях поля (~106 В/м) в электролите наблюдаются заметные отклонения от закона Ома. Они обусловлены тем, что при больших скоростях движения ионов происходит изменение условий взаимодействия как между ионами, так и ионов с молекулами растворителя.
|
|
|
Проводимость электролитов увеличивается при повышении температуры. Это происходит по двум причинам: во-первых, при увеличении температуры возрастает коэффициент диссоциации, во-вторых, увеличивается подвижность ионов из-за уменьшения вязкости электролита.
Прохождение электрического тока через электролит сопровождается электролизом - выделением на электродах составных частей растворенного вещества. Электролиз применяется для получения чистых материалов, например для получения рафинированной меди. Медные электроды погружаются в раствор медного купороса, молекулы которого диссоциируют на ионы:
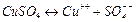 .
.
При протекании тока медный анод растворяется, чистая медь осаждается на катоде, а примеси и шлаки выпадают на дно. Законы электролиза были установлены Фарадеем.
Первый закон - количество вещества, выделившееся на электроде, пропорционально прошедшему через электролит заряду: 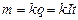 , где k - электрохимический эквивалент, численно равный массе вещества, выделившейся при прохождении через электролит заряда в 1 Кл.
, где k - электрохимический эквивалент, численно равный массе вещества, выделившейся при прохождении через электролит заряда в 1 Кл.
Второй закон - электрохимические эквиваленты всех веществ пропорциональны их химическим эквивалентам: 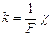 , где
, где 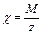 - химический эквивалент, М - молярная масса вещества, z - валентность,
- химический эквивалент, М - молярная масса вещества, z - валентность,
F = 9,648×104 Кл/моль - число Фарадея.
Оба закона можно объединить: 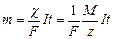 . (7.7)
. (7.7)
Законы Фарадея нетрудно объяснить с точки зрения ионной проводимости. Действительно, масса выделившегося вещества: 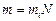 , где mi – масса иона, N – число прошедших через электролит ионов. С другой стороны
, где mi – масса иона, N – число прошедших через электролит ионов. С другой стороны 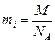 , где NA – число Авогадро;
, где NA – число Авогадро; 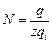 , где q =It. Следовательно, массу выделившегося вещества можно выразить как
, где q =It. Следовательно, массу выделившегося вещества можно выразить как 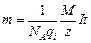 .
.
Сопоставляя с (7.7), имеем: 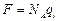 . Измерив на опыте число Фарадея, можно определить заряд одновалентного иона:
. Измерив на опыте число Фарадея, можно определить заряд одновалентного иона:
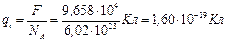 .
.
Кроме получения чистых металлов, электролиз используют в электрометаллургии расплавов (получение алюминия, натрия, магния и др.), для покрытия поверхности металлов декоративной или защитной пленкой (гальваностегия), для получения металлических слепков с рельефных моделей (гальванопластика), для электрической полировки поверхностей металлов.
 2015-05-26
2015-05-26 558
558






