 БИОГЕНЕЗ КЛЕТОЧНЫХ СТРУКТУР И ОНТОГЕНЕЗ РАСТИТЕЛЬНОЙ КЛЕТКИ
БИОГЕНЕЗ КЛЕТОЧНЫХ СТРУКТУР И ОНТОГЕНЕЗ РАСТИТЕЛЬНОЙ КЛЕТКИ
«То, что называют структурой, является медленным процессом большой продолжительности; то, что называют функцией, есть быстрый процесс короткой продолжительности».
Л. Берталанфи

Вода и питательные вещества — сахароза, амиды, аминокислоты и другие органические соединения, минеральные катионы и анионы, поступающие в клетки из проводящих пучков,—используются для синтеза веществ, из которых состоят сами клетки, т. е. белков, нуклеиновых кислот и других азотсодержащих соединений, Сахаров и полисахаридов, липидов, веществ вторичного метаболизма, таких, как витамины, фитогормоны, полифенолы, терпеноиды, алкалоиды и т. д.
В этих процессах первостепенную роль играют нуклеиновые кислоты, служащие для хранения и передачи информации, и белки, структура которых кодируется нуклеиновыми кислотами. Белки составляют основу всей жизнедеятельности клетки, в том числе и биогенеза клеточных структур. Один из основных принципов биогенеза клеточных структур — самосборка надмолекулярных комплексов.
Каждая клетка содержит два типа нуклеиновых кислот: дезоксирибонуклеиновые (ДНК) и рибонуклеиновые кислоты (РНК). У эукариот ДНК локализована в ядре, где является основным компонентом хромосом. В митохондриях и хлоропластах содержатся кольцевые ДНК прокариотического типа. Все три типа РНК: мРНК, рРНК и тРНК - синтезируются на матрице ДНК {транскрипция], причем транскрипты с ядерной ДНК отличаются по коэффициентам седиментации от аналогичных РНК, синтезированных в хлоропластах и митохондриях.
Синтез белков с участием всех форм РНК в составе полисом (трансляция) осуществляется как в цитоплазме, так и в хлоропластах и митохондриях. Коэффициенты седиментации (осаждения) рибосом цитоплазмы, митохондрий и хлоропластов равны соответственно 80S, 77 —78S и 70S.
В ДНК хранится информация о всех процессах, связанных с ростом, развитием и жизнедеятельностью организма, в виде сочетаний четырех нуклеотидов. Информация записывается вдоль цепи двойной спирали ДНК (триплетный код) в форме специфической для данного организма последовательности собранных в тройки азотистых оснований. Исходящая от ДНК информация кодирует аминокислотную последовательность синтезируемых белков. В свою очередь последовательность  аминокислот в белке определяет специфичность структуры и функции белка. Но в белке информация записана в виде кода из 20 аминокислот. Перевод информации с кода ДНК на двад-цатибуквенный код белка осуществляется с помощью рибонуклеиновых кислот.
аминокислот в белке определяет специфичность структуры и функции белка. Но в белке информация записана в виде кода из 20 аминокислот. Перевод информации с кода ДНК на двад-цатибуквенный код белка осуществляется с помощью рибонуклеиновых кислот.
По сравнению с прокариотами геном эукариотических клеток имеет значительно более сложное строение, что обусловлено огромным объемом информации, необходимой для развития и функционирования многоклеточного организма, дифференцированного на большое количество специализированных клеток, тканей и органов. В связи с этим в ходе эволюции возрастает масса ДНК в хромосомах и усложняется система управления и регуляции экспрессией генов.
Хромосомный аппарат эукариот характеризуется следующими особенностями.
1. В хроматине ядра ДНК связана с комплексами основных белков (гистонов) и негистоновыми белками, а также с небольшим количеством липидов и РНК. Двойная спираль ДНК и гистоны организованы в правильную периодическую структуру, состоящую из нуклеосом и участков молекулы ДНК между ними. Нуклеосомой называют комплекс, состоящий из восьми молекул гистоновых белков Н2А, Н2В, НЗ и Н4 (по 2 молекулы), на который «намотаны» петли ДНК из 140 — 200 пар нуклеотидов. Диаметр нуклеосомы около 10 нм. Между нуклеосомами локализованы участки ДНК из 30 — 50 пар нуклеотидов (длиной 10-20 нм), связанные с гистоном HI. Такая организация ДНК в хроматине позволяет ее молекуле укладываться в петли и в более сложные структуры. В составе нуклеосомы ДНК менее доступна для действия нуклеаз, которые легче расщепляют межнуклеосомные участки молекулы. В развернутом состоянии петли активны (осуществляется синтез ДНК или РНК), в неактивном состоянии петли свернуты в компактные структуры.
2. Гены (цистроны), кодирующие функционально связанные белки, как правило, рассредоточены по разным участкам хромосом (за исключением гистоновых генов и генов рРНК), а не объединены в опероны, как у прокариот.
3. Большинство молекул РНК синтезируется в виде более высокомолекулярных предшественников (проРНК). После образования первичного транскрипта происходит его процес-синг (созревание), который, как будет показано ниже, включает в себя кэширование (от англ, cap — шапочка) и метилирование, полиаденилирование, фрагментацию и сплайсинг (от англ, splicing — сращивание двух концов). Полупериод жизни большинства молекул мРНК эукариот составляет от 3 — 6 до 48 ч.
4. В ДНК эукариот помимо уникальных последовательностей нуклеотидов, встречающихся, как правило, один раз (большинство структурных генов, кодирующих мРНК), имеется огромное количество повторяющихся последовательностей — повторов (см. рис. 2.3). Число повторов колеблется от десятков и сотен (среднечастотные повторы) до 10б раз на геном (высокочастотные повторы). У высших растений доля уни  кальных участков в геноме часто составляет всего 20 — 30%. Часть повторов необходима для синтеза рРНК и гистонов, но большинство повторов, по-видимому, необходимо для регуляции экспрессии генов. Большую часть генома занимают интроны — участки ДНК, включенные в состав структурных генов, но не кодирующие их специфический продукт (в отличие от экзонов — участков ДНК, на которых синтезируется специфический транскрипт данного гена). В состав генов входят также спейсеры (от англ, spacer — прокладка), которые либо не считываются вообще, либо транскрибируются, но затем разрушаются (см. рис. 2.2).
кальных участков в геноме часто составляет всего 20 — 30%. Часть повторов необходима для синтеза рРНК и гистонов, но большинство повторов, по-видимому, необходимо для регуляции экспрессии генов. Большую часть генома занимают интроны — участки ДНК, включенные в состав структурных генов, но не кодирующие их специфический продукт (в отличие от экзонов — участков ДНК, на которых синтезируется специфический транскрипт данного гена). В состав генов входят также спейсеры (от англ, spacer — прокладка), которые либо не считываются вообще, либо транскрибируются, но затем разрушаются (см. рис. 2.2).
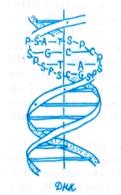
Структура ДНК. ДНК — высокомолекулярный полимер, состоящий из сочетаний четырех нуклеотидов. Нуклеотиды ДНК включают пуриновое (аденин, гуанин) и пиримидиновое (цито-зин, тимин) азотистые основания, сахар — дезоксирибозу и остатки фосфорной кислоты. Молекула ДНК представляет собой двойную спираль, состоящую из двух спирально закрученных полимерных цепей, в каждой из которых нуклеотиды ковалентно связаны через остатки фосфорной кислоты в 3' — 5'-положениях дезоксирибозы. Между собой две полинуклео-тидные цепи взаимодействуют водородными связями, возникающими между повернутыми внутрь спирали пуриновыми и пиримидиновыми основаниями. При взаимодействии азотистых оснований аденин всегда взаимодействует с тимином, гуанин — с цитозином (5-метилцитозином). Таким образом, возможны четыре варианта пар оснований: А-Т, Т-А, Г-Ц, Ц-Г. Это строго избирательное стерическое взаимодействие (комплементарность, или дополнительность) является важным принципом, лежащим в основе воспроизводства самой ДНК, ДНК-зависимых синтезов всех РНК и синтеза белков в клетке. В молекулах ДНК эукариот насчитывается 109 —1011 пар оснований.
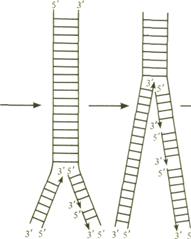
 Синтез ДНК. Синтез ДНК (репликация, т. е. копирование) в ядре происходит в определенный период митотического цикла (см. 10.3.1) в присутствии трифосфатов всех четырех дезок-синуклеотидов, ионов Mg2+, ДНК-затравки и ДНК-полиме-разы. Репликация ДНК осуществляется полуконсервативным способом, который заключается в том, что молекула ДНК удваивается путем репликации каждой из двух ее цепей. Поэтому каждая двойная спираль ДНК состоит из «старой» и «новой» полинуклеотидных цепей.
Синтез ДНК. Синтез ДНК (репликация, т. е. копирование) в ядре происходит в определенный период митотического цикла (см. 10.3.1) в присутствии трифосфатов всех четырех дезок-синуклеотидов, ионов Mg2+, ДНК-затравки и ДНК-полиме-разы. Репликация ДНК осуществляется полуконсервативным способом, который заключается в том, что молекула ДНК удваивается путем репликации каждой из двух ее цепей. Поэтому каждая двойная спираль ДНК состоит из «старой» и «новой» полинуклеотидных цепей.
В процессе репликации двуспиральная структура ДНК локально расплетается в нескольких местах одновременно. Из этих мест репликация идет в обоих направлениях до встречи реплицирующихся участков. Новая цепь синтезируется ДНК-полимеразой и на всех участках соблюдается полярность сборки полимера: считка идет от З'-конца одной цепи к ее 5'-концу, а синтезируется комплементарная цепь в направлении 5' →3'. В процессе репликации ДНК взаимодействует комплекс факторов, включающий ДНК-полимеразу, факторы начала репликации и компонент, ответственный за локальное расплетание двойной цепи ДНК (см. схему).

Структура и формы РНК. Все РНК также построены из нуклеотидов четырех оснований: аденина и гуанина (пурины) и цитозина и урацила (пиримидины). Урацил заменяет в РНК тимин ДНК. В качестве пентозы используется рибоза. а не дезоксирибоза. Размеры РНК очень различны. Матричная РНК имеет от нескольких тысяч до десятков тысяч нуклеотидных последовательностей (10-405). но составляет 1 — 3°0 от суммарной РНК в клетке. В состав рибосом входят четыре рРНК с коэффициентами седиментации Сведберга 185, 5,85, 285 (синтезируются в ядрышке) и 55-РНК (синтезируется в нескольких хромосомах). В своем составе тРНК содержат 75-80 нуклеотидов, их в клетке более 20 различных форм (для каждой аминокислоты своя тРНК).
Молекулы РНК не образуют двойной спирали, но в разных участках одной полинуклеотидной цепи спариваются комплементарные последовательности оснований, что приводит к образованию петель и формированию молекулы. Так, молекулы тРНК имеют вторичную структуру в форме трилистника (клеверного листа). В состав тРНК входит много метилированных и других необычных нуклеозидов.
Синтез РНК. Синтез РНК осуществляется с участием РНК-полимераз. В ядрах эукариот функционируют три РНК-поли-меразы. РНК-полимераза I связана с синтезом рРНК и находится в ядрышке. РНК-полимераза II осуществляет синтез мРНК, РНК-полимераза III — транскрипцию тРНК и 55-рРНК. Эти две полимеразы локализованы в хроматине и нуклеоплазме. Максимум активности РНК-полимеразы I наблюдается при рН 8,5, низкой ионной силе и в присутствии М§2+. Для РНК-полимеразы II требуется рН 7.5. высокая ионная сила и ионы Мп2+.
Синтез РНК осуществляется на матрице ДНК. На рис. 10.1 на примере образования мРНК представлены основные этапы этого процесса. РНК-полимераза II, перемещаясь по одной из нитей ДНК от 3'- к 5'-концу, осуществляет синтез РНК. при чем считываются как экзоны, так и интроны. 5'-конец про-мРНК кэпируется благодаря присоединению 7'-метилгуанозина.
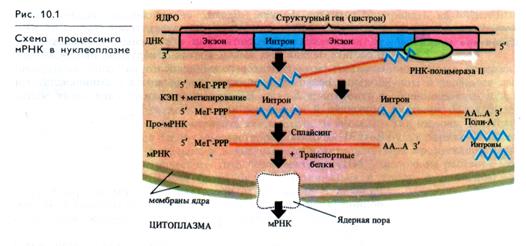
Одновременно метилируются некоторые основания про-мРНК. Когда закончился процесс транскрипции и молекула про-мРНК отделилась от матрицы, ее З'-конец полиаденилируется за счет присоединения поли-А. В ходе сплайсинга вырезаются интроны и сшиваются экзоны, в результате чего формируется молекула мРНК, которая, образуя комплекс с транспортными белками, преодолевает ядерную пору и попадает в цитоплазму.
Предполагается, что кэпирование и полиаденилирование защищают молекулу мРНК от разрушения нуклеазами а КЭП (7'-метилгуанозин), кроме того, участвует в механизме сборки полисомного комплекса, в который в качестве матрицы для синтеза белка входит мРНК.
Регуляция процессов транскрипции осуществляется на многих уровнях:
а) путем разрыхления плотной упаковки хроматина за счет модификации структуры гистонов (их метилирования, ацетилирования, фосфорилирования и т. д.);
б) изменением активности и локализации РНК-полимераз;
в) контролированием всех этапов процессинга (на рис. 2.3 приводилась одна из возможных схем активации процессинга молекул про-мРНК с участием эффекторов, в качестве которых могут выступать как фитогормоны, так и субстраты);
г) путем связывания (маскирования) зрелых мРНК в рибо-нуклеопротеиновых комплексах (информосомах) и освобождения из них.
Существенную роль в регуляции процессов транскрипции играют специфические негистоновые белки, выступающие в качестве активаторов и репрессоров, рецепторов физиологически активных веществ (фитогормонов), ферментов, модифицирующих нуклеотиды и гистоны, и др.
 Структура белков. Белки, составляющие основу цитоплазмы, являются полимерами с молекулярной массой от 5000 до нескольких миллионов. Они построены из аминокислот. В составе белков всех живых клеток обнаружено около 20 аминокислот, хотя небелковых аминокислот найдено значительно больше. Белковые аминокислоты являются α- аминокислотами и относятся к L-ряду. Их строение отражает следующая общая формула:
Структура белков. Белки, составляющие основу цитоплазмы, являются полимерами с молекулярной массой от 5000 до нескольких миллионов. Они построены из аминокислот. В составе белков всех живых клеток обнаружено около 20 аминокислот, хотя небелковых аминокислот найдено значительно больше. Белковые аминокислоты являются α- аминокислотами и относятся к L-ряду. Их строение отражает следующая общая формула:
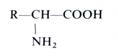
Радикал R может быть представлен атомом водорода, углеродной (алифатической или ароматической) группировкой, может содержать полярные группы, карбоксильную или основную группы.
В молекуле белка отдельные аминокислоты соединяются с помощью пептидной связи — NH —СО—. Объединение двух аминокислот дает дипептид, трех — трипептид и т. д. Многие полипептиды встречаются в растениях в свободном состоянии и являются физиологически активными (например, трипептид глутатион). Помимо пептидных связей, в молекулах белков есть еще один тип ковалентных связей — дисульфидные, которые могут соединять участки молекулы или отдельные полипептидные цепи. Остальные типы связей в молекуле белка более слабые. Это водородные, ионные связи (между основными и кислыми группами) и гидрофобные взаимодействия (сближение неполярных частей полипептидных цепочек, что приводит к уменьшению их взаимодействия с водой).
Структуру белка определяет полипептидная цепь из специфической последовательности аминокислот, связанных ковалентными пептидными связями. Она составляет первичную структуру белка.
Взаимодействие боковых групп белковой молекулы приводит к образованию водородных связей между определенными участками, что обусловливает спиральное закручивание молекулы, ее α-спиральную структуру. Почти все белки обладают α-структурой, но не обязательно на протяжении всей цепи: спирализованными могут быть отдельные участки. Кроме α-структуры в белках встречается β-структура. Она также обусловлена водородными связями, но не внутри одной полипептидной цепи, а между соседними цепями с образованием «складчатой» структуры, α- и β- Структуры определяют вторичную структуру белка.
Разнообразная укладка в пространстве спиральной молекулы белка, создающая ее специфическую конфигурацию, называется третичной структурой молекулы. Ферменты и другие белковые образования часто состоят из различных белков (субъединиц), объединенных нековалентными (водородными, ионными, ван-дер-ваальсовыми) связями. Эти комплексы образуют четвертичную структуру белков. Белки, обладающие че твертичной структурой, могут диссоциировать на отдельные субъединицы и вновь собираться в комплекс.
По форме молекулы различают фибриллярные и глобу-
лярные белки.
 Белки, как и входящие в их состав аминокислоты, содержат свободные карбоксильные и аминные группы и являются ам-фотерными соединениями, т. е. могут функционировать и как кислоты, и как основания. В щелочном растворе белок будет диссоциировать как кислота, в кислом — как щелочь. Поэтому в щелочном растворе молекулы белков будут заряжены отрицательно, а в кислом — положительно. При пропускании электрического тока через раствор белка в щелочном растворе молекулы белка будут перемещаться к аноду, а в кислом — к катоду.
Белки, как и входящие в их состав аминокислоты, содержат свободные карбоксильные и аминные группы и являются ам-фотерными соединениями, т. е. могут функционировать и как кислоты, и как основания. В щелочном растворе белок будет диссоциировать как кислота, в кислом — как щелочь. Поэтому в щелочном растворе молекулы белков будут заряжены отрицательно, а в кислом — положительно. При пропускании электрического тока через раствор белка в щелочном растворе молекулы белка будут перемещаться к аноду, а в кислом — к катоду.
Кислая среда Изоэлектрическа.я точка Щелочная среда
Я— СН- СООН К— СН— СОСГ К— СН— СОО
Реакция среды, при которой устанавливается равенство положительных и отрицательных зарядов молекул белка, называется изоэлектрической точкой. В этой точке белок обладает наименьшей растворимостью и наиболее легко осаждается из раствора.
Вследствие гидрофидьности различных групп белковой молекулы (например. — СООН связывает четыре молекулы воды, а — >Ш2 — одну) белок имеет водную оболочку, причем молекулы воды, расположенные ближе к поверхности белка, ориентированы строго определенным образом, а на периферии молекулы — более беспорядочно. Водная оболочка белков способствует устойчивости молекулы.
При определенных условиях белки приобретают в растворе (в цитоплазме) структуру геля. Это связано с образованием из свободных белковых молекул сложной сетеподобной структуры, внутри которой находятся ориентированные молекулы воды. При разрушении сети и переходе белков вновь в растворимую мономолекулярную форму цитоплазма приобретает менее вязкое, более оводненное состояние золя. Эти обратимые переходы гель — золь очень важны при функционировании цитоплазмы.
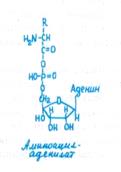
Синтез белков. Каждый белок характеризуется присущей только ему последовательностью аминокислот. Уникальность его строения обеспечивается структурой мРНК, образовавшейся в результате транскрипции специфической для данного белка последовательности оснований ДНК. Информация о структуре белка заложена в мРНК в форме кодонов, состоящих из последовательности трех оснований — триплетов, каждый из которых эквивалентен конкретной аминокислоте. Поскольку в состав нуклеотидов РНК входят четыре основания, то для аминокислот возможны 64 кодона. Это означает, что каждая аминокислота кодируется более чем одним кодоном.
Синтез белка осуществляется на матрице мРНК в цитоплазме в процессе трансляции.
Механизмы трансляции сложнее процессов транскрипции. В то время как транскрипцию обеспечивают 1,5 — 2 десятка белков, для трансляции необходимы не менее 50 специализированных белков. Интенсивность и направленность трансляции зависят от: а) концентрации информационных матриц, т. е. специфических мРНК, уровень которых определяется их синтезом, транспортом, хранением, активацией и распадом; б) присутствия всех других компонентов аппарата трансляции (рибосом, тРНК, аминокислот, АТР, GTP, синтетаз, внерибосомных факторов трансляции, регуляторных белков); в) необходимых физико-химических условий (рН, ионов).
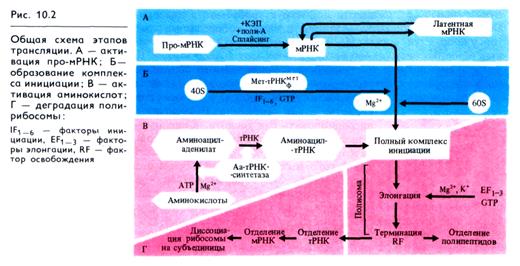
Рассмотрим возможные системы регуляции при активации мРНК и аминокислот, формирования и работы полирибосом-ного комплекса и разрушения отработанных матриц. Появление молекул мРНК в цитоплазме — главное условие образования полирибосом (полисом). Сдвиги в содержании матриц для синтеза тех или иных белков происходят благодаря индукции или усилению синтеза про-мРНК и их процессинга, а также за счет освобождения мРНК из латентной формы (рис. 10.2, А). Эти процессы находятся под контролем физико-химических факторов в нуклеоплазме и специфических регуляторных молекул, в частности фитогормонов.
Регуляция синтеза белков может осуществляться при формировании инициаторного комплекса (рис. 10.2, Б). Промежуточный комплекс инициации образуется путем взаимодействия малой рибосомальной субъединицы (40S) с инициаторной метионил-тРНКмет, которая затем связывается с мРНК. В образовании и стабилизации этого комплекса принимают участие GTP и несколько белковых факторов (получивших название факторов инициации IF1-6), а у растений — еще и АТР. Последней к инициаторному комплексу присоединяется большая рибосомальная субъединица (60S).
 На всех этих этапах регулирующим фактором может быть любой из участников комплекса, если он будет находиться в минимуме, а также физико-химические условия микросреды.
На всех этих этапах регулирующим фактором может быть любой из участников комплекса, если он будет находиться в минимуме, а также физико-химические условия микросреды.
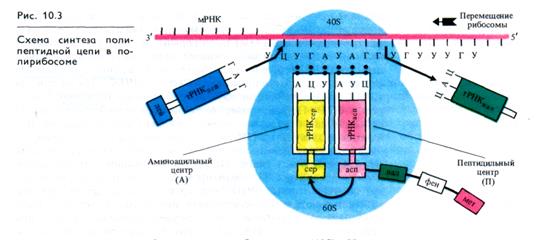
Процесс синтеза полипептида кроме инициации проходит фазы элонгации и терминации. Для включения в полипептид аминокислоты предварительно активируются, превращаясь с участием АТР и аминоацил-тРНК-синтетаз в аминоациладе- нилаты (рис. 10.2, В), которые затем под действием тех же ферментов присоединяются к соответствующим тРНК. Для каждой аминокислоты существуют по крайней мере одна специфическая тРНК и одна аминоацил-тРНК- синтетаза.
Рост полипептидной цепи начинается с 5:конца мРНК и протекает циклично, причем три этапа цикла повторяются до тех пор, пока не закончится образование всего полипептида. На первом этапе каждая специфическая тРНК, доставившая аминокислоту к рибосоме, связывается своим триплетным антикодоном с комплементарным кодоном мРНК в аминоациль-ном (А) центре (рис. 10.3). Это связывание зависит от присутствия двух факторов элонгации EF, один из которых взаимодействует с GTP. На втором этапе между новой аминокислотой, связанной с тРНК, и синтезирующейся полипептидной цепью образуется пептидная связь при участии пептидил-трансферазы, причем полипептид из пептидилыюго (П) центра переносится на новую аминокислоту в А- центр. При этом расщепляется GTP и освобождаются факторы элонгации и GDP. На третьем этапе пептидил- тРНК перемещается из А-центра в П-центр, что сопряжено с освобождением из П-центра использованной тРНК. Для отделения тРНК от П-центра необходимо участие третьего фактора элонгации, обладающего при взаимодействии с рибосомой ОТРазной активностью. В результате перемещения рибосомы очередной кодон мРНК попадает в А- центр. Для процесса транслокации используется энергия гидролиза второй молекулы GTP.
 Синтез полипептидной цепи в рибосомном комплексе осуществляется до тех пор, пока не будет достигнут терминальный кодон мРНК. С этим кодоном связывается белковый фактор терминации (RF), который не только распознает нужный кодон, но и обеспечивает отщепление полипептидной цепи от тРНК (см. рис. 10.2, Г). После отделения полипептида отщепляются деацилированная тРНК и мРНК. Для отделения мРНК требуется участие двух внерибосомных белковых факторов и GTP. Процесс завершается диссоциацией рибосомы на субъединицы с участием одного из факторов инициации IF3. Каждая молекула мРНК может считываться многократно.
Синтез полипептидной цепи в рибосомном комплексе осуществляется до тех пор, пока не будет достигнут терминальный кодон мРНК. С этим кодоном связывается белковый фактор терминации (RF), который не только распознает нужный кодон, но и обеспечивает отщепление полипептидной цепи от тРНК (см. рис. 10.2, Г). После отделения полипептида отщепляются деацилированная тРНК и мРНК. Для отделения мРНК требуется участие двух внерибосомных белковых факторов и GTP. Процесс завершается диссоциацией рибосомы на субъединицы с участием одного из факторов инициации IF3. Каждая молекула мРНК может считываться многократно.
Механизмы регуляции процессов элонгации и терминации изучены еще очень слабо. На уровне элонгации помимо факторов элонгации и GTP лимитировать синтез полипептидов могут изоакцепторные тРНК, спектр которых меняется при разных физиологических состояниях организма и тех или иных воздействиях (например, при дифференцировке тканей, при действии гормонов и т. д.). Существенную роль для синтеза пептидных связей в пептидильном центре рибосомы играют физико-химические условия микросреды (наличие ионов Mg2+, Са2+, Мп2+, рН 8,3-8,4 и т.д.).
В клетках в каждый данный отрезок времени синтез белков обеспечивает определенную физиологическую программу. Поэтому активация и считка большого количества мРНК, кодирующих новообразование функционально связанных белков, должны быть строго скоординированы. Так, на ряде объектов показано, что в норме относительное количество различных тРНК в клетках соответствует набору кодонов транслируемых матриц. Особенно хорошо это прослеживается в клетках, где осуществляется массовый синтез специфических белков. Количество рРНК. факторов элонгации также строго скоординировано с содержанием тРНК и количеством активных матриц. При изменении физиологического состояния клетки концентрации всех этих компонентов аппарата трансляции одновременно возрастают или падают. В модельных опытах установлено, что избыток тРНК тормозит скорость трансляции. Снижение интенсивности синтеза белков в свою очередь тормозит транспорт мРНК из ядра в цитоплазму.
Таким образом, в клетках функционируют системы регуляции, не только координирующие транскрипцию различных классов РНК и трансляцию различных белков, но и обеспечи вающие тесное взаимодействие всех этих процессов. Процессы транскрипции и трансляции — первый этап на пу ти формирования внутриклеточных структур. Следующие этапы — сборка надмолекулярных комплексов и их доставка в определенные участки клетки.
Первичная структура белка, т. е. последовательность аминокислот в молекуле полипептида, определяет его вторичную и третичную структуры. Взаимодействие белковых молекул с другими белковыми и небелковыми органическими соединениями приводит к образованию четвертичной структуры белков и их встраиванию в те надмолекулярные комплексы, для которых эти белки предназначены. Все эти этапы превращений белковой молекулы, начиная от синтеза ее рибонуклеиновой матрицы и до вхождения наряду с другими соединениями в состав определенных компонентов клетки, связаны с процессами самосборки. Именно эти процессы лежат в основе формирования и биогенеза клеточных структур.
 Самосборка — это процесс спонтанной агрегации однородных или разнородных молекул, который приводит к упорядочению молекул и росту многокомпонентных структур. Самосборку можно рассматривать как процесс кристаллизации, если агрегация молекул не сопровождается образованием ковалентных связей. Если же вслед за самосборкой возникают ковалентные связи, то такой процесс называют полимеризацией.
Самосборка — это процесс спонтанной агрегации однородных или разнородных молекул, который приводит к упорядочению молекул и росту многокомпонентных структур. Самосборку можно рассматривать как процесс кристаллизации, если агрегация молекул не сопровождается образованием ковалентных связей. Если же вслед за самосборкой возникают ковалентные связи, то такой процесс называют полимеризацией.
Механизмы самосборки основаны на слабых взаимодействиях. В первую очередь ориентирующее влияние на молекулы начинают оказывать дальнодействующие электростатические силы (на расстоянии 0,7 нм). Затем взаимное притяжение молекул дополняется водородными связями и, наконец, на расстоянии 0,1 нм начинают проявляться ван-дер-ваальсовы и гидрофобные взаимодействия. Ван-дер-ваальсовы силы возникают между нейтральными атомами и молекулами вследствие их поляризации. Избирательность механизма самосборки обеспечивается благодаря существованию у молекул биополимеров участков узнавания, комплементарных к определенным локусам молекул-партнеров. Комплементарными (дополняющими друг друга) называют стерические структуры, которые могут входить в контакт с несколькими атомами или группами атомов, способными к попарным нековалентным взаимодействиям. Этим обеспечивается высокое сродство и специфичность образования такого рода комплексов. Самосборка молекул происходит со снижением свободной энергии и потому самопроизвольно. Так как в процессе участвуют лишь слабые связи, самосборка молекул обратима.
Характер самосборки предопределяется особенностями первичной структуры полимера, однако во многих случаях происходит дополнительная регуляция процесса агрегации. В качестве регулятора могут выступать физико-химические условия среды, специализированные молекулы-регуляторы и другие факторы. Очень важный элемент узнавания — подстройка структуры одного из полимеров к месту связывания другого, что создает наиболее точное стерическое соответствие взаимодействующих участков молекул. Например, установлено, что РНК-полимераза способна «приспосабливаться» к месту присоединения в молекуле ДНК (промотору), приобретая различную конфигурацию на разных промоторах.
Самосборка в биологических системах проявляется в бис-лойном расположении фосфолипидов в мембранах, комплементарной последовательности азотистых оснований в нуклеиновых кислотах, во взаимодействии фермента и субстрата, белка-рецептора и эффектора (например, фитогормона), в сборке многокомпонентных ферментативных комплексов и т. д. Например, рибулозодифосфаткарбоксилаза в хлоропластах собирается из восьми больших и восьми малых субъединиц.
 Большие субъединицы синтезируются в хлоропластах и выполняют каталитическую функцию, а малые образуются в цитоплазме и необходимы для регуляции активности фермента. Нитрогеназный комплекс строится из двух компонентов: железосодержащего белка и комплекса из четырех субъединиц и отдельного кофактора, в состав которых входят негемовое железо и молибден. Мультиэнзимные комплексы, выполняющие последовательные реакции в метаболических циклах, также монтируются в мембранах или на элементах цитоскелета путем самосборки.
Большие субъединицы синтезируются в хлоропластах и выполняют каталитическую функцию, а малые образуются в цитоплазме и необходимы для регуляции активности фермента. Нитрогеназный комплекс строится из двух компонентов: железосодержащего белка и комплекса из четырех субъединиц и отдельного кофактора, в состав которых входят негемовое железо и молибден. Мультиэнзимные комплексы, выполняющие последовательные реакции в метаболических циклах, также монтируются в мембранах или на элементах цитоскелета путем самосборки.
Предполагается, что в составе живой клетки имеются комплементарно связанные блоки ферментов и других биополимеров, эти блоки в свою очередь комплементарно объединены друг с другом и таким образом создают единую взаимосвязанную систему (Б. Ф. Поглазов, 1977). В связи с этим нужно отметить, что в водной среде, в том числе в цитоплазме, агрегация веществ приводит к образованию жидкокристаллического состояния веществ системы.
Жидкокристаллическое состояние можно рассматривать как четвертое состояние вещества. Жидкие кристаллы более структурированы, чем жидкости, и менее, чем эти же вещества в твердом виде. Белки, нуклеиновые кислоты, полисахариды, липиды, темы образуют в воде жидкокристаллические структуры. Важное свойство жидких кристаллов — их структурная упорядоченность и одновременно молекулярная подвижность. Такие жидкие кристаллы «реагируют» на разнообразные воздействия внешней среды — свет, звук, механическое давление, изменение температуры, электрические и магнитные поля, на химические изменения в окружающей среде, т. е. обладают свойством, характерным и для живых клеток (Г. Браун, Дж. Уолкен, 1982).
Самосборка мембран. Входящие в состав мембран белки и липиды способны к самосборке. Гидрофобные мембранные белки ассоциируют друг с другом. Предполагается, что структурные белки мембран определяют ориентацию других мембранных белков. В формировании липидных компонентов мембран участвуют липиды, синтезируемые в гладком ЭР, хлоропластах, а также локализованные в липидных каплях (сферосомах). Гликопротеины и гликолипиды, синтезированные в АГ, доставляются в везикулах к месту сборки.
Процесс сборки протекает в несколько этапов в соответствии с принципом взаимного «узнавания» составных частей и липид-липидных, белок-белковых, липид-белковых взаимодействий. Прочность мембранам придают гидрофобные связи между компонентами. Кроме того, в формировании плазма-леммы участвуют готовые мембранные блоки везикул Гольджи, встраивающиеся в нее в процессе секреции компонентов клеточной стенки.
Самосборка полисом. Сборка субъединиц рибосом осуществляется поэтапно. Вначале последовательно встраиваются белки, специфичные для каждой субъединицы с участием структур 28S и 18S рРНК. Малая рибосомальная субъединица взаимодействует с инициаторной тРНК в присутствии GTP, АТР и белковых факторов инициации. Этот комплекс связывается с мРНК в присутствии ионов магния. Последней к мРНК присоединяется большая рибосомальная субъединица (см. рис. 10.2).
Поскольку одну молекулу мРНК могут транслировать несколько рибосом, из которых каждая собирается на мРНК аналогичным образом, в цитоплазме возникают полирибосомные комплексы. Другим типом полирибосом являются шероховатый ЭР и наружная мембрана ядерной оболочки, на которых также собираются рибосомы.
Самосборка микротрубочек и микрофиламентов. Микротрубочки жгутиков, кортикального слоя цитоплазмы и митотиче-ского аппарата построены по единому плану из глобулярного белка тубулина. Для сборки микротрубочек необходимы кислый рН среды, присутствие магния, GTP и АТР. Сборка чувствительна и к ионам Са2+: их избыток (0,02 ммоль/л и выше) способствует разборке микротрубочек.
Скорость сборки зависит также от концентрации свободных мономеров тубулина. В контроле сборки микротрубочек участвуют связанные с поверхностью микротрубочек белки. Сборка осуществляется в два этапа. Вначале собирается затравка (ядро), а затем микротрубочка растет путем сборки субъединиц. Существует критическая концентрация мономеров тубулина, превышение которой индуцирует сборку микротрубочек.
Микротрубочки — поляризованные структуры. Их сборка инициируется в центрах-организаторах микротрубочек, которыми служат, например, скопления мембран ЭР на полюсах веретена (аналог центриоли), кинетохоры хромосом. Если один конец микротрубочки локализован в центре-организаторе, то прирост ее осуществляется у свободного (дистального) конца. У изолированных микротрубочек полярность выражается в различной скорости сборки у двух концов.
 В цитоплазме растительных клеток обнаружен немышечный актин. Сборка глобулярных мономеров Г-актина в двойную спираль фибриллярного Ф-актина происходит с затратой энергии АТР в присутствии Mg2 +. Фибриллярный актин образует пучки микрофиламентов, принимающие участие в движении цитоплазмы. Помимо микрофиламентов, актин может формировать тонкие фибриллы, способные замыкаться, создавая се-теподобную структуру в цитоплазме. Превращение фибрилл актина в замкнутые структуры приводит к местному обратимому желатинированию цитоплазмы, что вызывается локальным увеличением концентрации ионов кальция. Это наблюдается, например, при прохождении потенциала действия по клетке междоузлия нителлы.
В цитоплазме растительных клеток обнаружен немышечный актин. Сборка глобулярных мономеров Г-актина в двойную спираль фибриллярного Ф-актина происходит с затратой энергии АТР в присутствии Mg2 +. Фибриллярный актин образует пучки микрофиламентов, принимающие участие в движении цитоплазмы. Помимо микрофиламентов, актин может формировать тонкие фибриллы, способные замыкаться, создавая се-теподобную структуру в цитоплазме. Превращение фибрилл актина в замкнутые структуры приводит к местному обратимому желатинированию цитоплазмы, что вызывается локальным увеличением концентрации ионов кальция. Это наблюдается, например, при прохождении потенциала действия по клетке междоузлия нителлы.
1 Биогенез хлоропластов. В онтогенезе клетки хлоропласты формируются из пластид со слаборазвитой системой внутрен них мембран — пропластид, присутствующих в меристематиче- ских клетках (рис. 10.4). Развитие хлоропласта из пропластиды сопровождается дифференцировкой мембранной системы (образованием ламелл и гран) через ряд видоизменений пластиды.
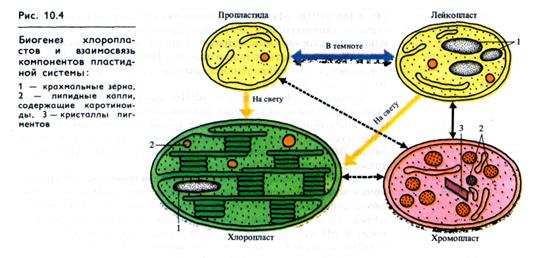
Одновременно осуществляется синтез и происходит пространственная организация пигментов, светособирающих комплексов, белков ФС I и ФС II и других компонентов. Перестройка мембранной системы хлоропластов и других пластид сопровождается постоянным обновлением структуры мембран, разрушением липидов и белков и включением в мембраны новых компонентов.
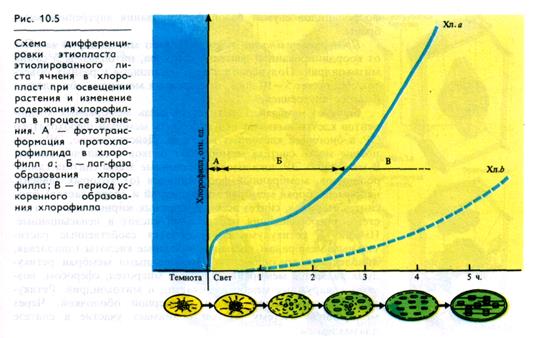
Биогенез хлоропластов осуществляется только на свету. Он наглядно прослеживается при развитии хлоропластов из сформировавшихся в темноте этиопластов. Превращение этиопла-ста в хлоропласт сопровождается активным синтезом хлоро-пластных мРНК, рРНК, синтезом структурных белков и других компонентов. При этом под влиянием света прото-хлорофиллид этиопластов очень быстро превращается в хлорофилл а (рис. 10.5, А). Затем около 2 ч длится фаза медленного изменения концентрации хлорофиллов (рис. 10.5, Б), после которой их синтез значительно возрастает (рис. 10.5, В). К этому моменту ламеллярная структура хлоропласта уже сформировалась, но гран еще нет. Предполагается, что образование тила-коидов и гран из них связано с синтезом прежде всего белковых компонентов ССК и ФС II в полисомах хлоропластов, имеющих вид колец. Белковые комплексы ФС II и ССК являются организаторами гран.
Количество хлоропластов при росте клетки увеличивается путем деления пропластид или дифференцирующихся хлоропластов. При делении ламеллярная система пересекается перемычкой поперек органоида. В ряде случаев наблюдалось почкование хлоропластов. Вслед за делением увеличивается размер дочерних хлоропластов. Деление хлоропластов происходит через 6 —20 ч и не обязательно одновременно с делением ядра. Деление пластид может регулироваться красным светом (660 нм) и устраняется облучением дальним красным светом (730 нм).
Предполагается, что роль фоторецептора могут выполнять фитохром (при низких интенсивностях света), протохлорофиллид и фоторегуляторы, поглощающие в синей области спектра, например флавины (при высоких интенсивностях света). Деление останавливается также низкой температурой.
Биогенез митохондрий. Собственная генетическая система и способность митохондриальной ДНК к репликации позволяют митохондриям размножаться самостоятельно. Поэтому в клетке митохондрии образуются из предшествующих митохондрий и, возможно, из промитохондрий. В меристематических клетках обнаруживаются митохондрии, разделенные перетяжкой. При переходе меристематической клетки к росту растяжением число митохондрий в клетке возрастает в 3 — 8 раз и меняется их структура.
Рост мембран митохондрий при функциональной нагрузке или после их деления происходит путем достройки. В настоящее время процесс биогенеза мембран митохондрий изучен недостаточно. Известно, что сборка ферментных комплексов идет медленнее, чем синтез их компонентов на цитоплазматических и митохондриальных рибосомах. Поэтому в клетке существуют фонды свободных предшественников.
Большинство белков, входящих в состав митохондрий, синтезируется в цитоплазме. Лишь 5-15% белков — продукты трансляции митохондриальных полисом, причем эти белки входят исключительно в состав внутренней мембраны митохондрий. Белки митохондриального происхождения являются гидрофобными полипептидами и их самосборка с участием фосфолипидов служит базой формирования внутренней мембраны.
Продолжительность жизни (оборот) митохондрий зависит от координированной деятельности ядра, цитоплазмы и самих митохондрий. Полупериод жизни органоидов у разных объектов составляет 5—10 дней, но наружная мембрана обновляется быстрее внутренней.
Биогенез мембран. Генетическая связь мембранных компонентов клетки выявляет ведущую роль мембран шероховатого ЭР в биогенезе клеточных мембран. Действительно, ЭР — основное место синтеза мембранных белков и липидов клетки. В мембранах ЭР локализованы конечные этапы синтеза глицеролипидов, мембранных фосфолипидов (от которых зависит, например, сборка мембран митохондрий и хлоропластов), биосинтез стеролов, синтез всех насыщенных жирных кислот и системы преобразования насыщенных кислот в ненасыщенные. Именно в ретикулуме синтезируются свойственные растительным мембранам полиеновые жирные кислоты (линолевая, линоленовая, арахидоновая). Производными мембран ретику-лума являются мембраны вакуолей, микротел, сферосом, возможно, наружные мембраны пластид и митохондрий. Ретику-лум непосредственно связан с ядерной оболочкой. Через мембранную систему АГ он принимает участие в синтезе плазмалеммы:
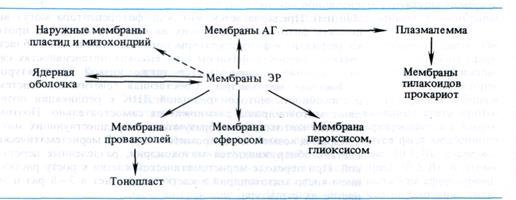
 Переход мембран друг в друга получил название «тока мембран». В настоящее время процесс тока мембран рассматривается как составная часть более широкого представления о взаимодействии мембранных компонентов клетки — концепции эндомемдранной системы. Эта концепция объясняет функциональную непрерывность мембран, учитывая явление дифференциации мембран и «ток мембран».
Переход мембран друг в друга получил название «тока мембран». В настоящее время процесс тока мембран рассматривается как составная часть более широкого представления о взаимодействии мембранных компонентов клетки — концепции эндомемдранной системы. Эта концепция объясняет функциональную непрерывность мембран, учитывая явление дифференциации мембран и «ток мембран».
Рассмотренные выше многоступенчатые процессы биогенеза клеточных структур можно представить в виде следующей схемы: ДНК→РНК→белки→ самосборка надмолекулярных функционально активных блоков→функциональная активность метаболических циклов, клеточных органоидов. Однако еле дует иметь в виду, что характер считки информации с ДНК, т. е. конкретный состав генов, которые подвергаются экспрессии, закономерно меняется, в связи с чем клетка проходит ряд этапов своего развития.

 Период существования клетки от момента ее образования в результате деления материнской клетки до ее собственного деления или смерти представляет собой жизненный цикл клетки, или ее онтогенез. Онтогенез растительной клетки слагается из ряда последовательных этапов: деления, роста растяжением, дифференцировки, старения и смерти.
Период существования клетки от момента ее образования в результате деления материнской клетки до ее собственного деления или смерти представляет собой жизненный цикл клетки, или ее онтогенез. Онтогенез растительной клетки слагается из ряда последовательных этапов: деления, роста растяжением, дифференцировки, старения и смерти.
Митоз. Митоз — это такой способ деления клеток, при котором число хромосом удваивается, так что каждая дочерняя клетка получает двойной набор хромосом, тождественный хромосомам материнской клетки. В процессе митоза происходят сложные последовательные изменения структуры ядра и цитоплазмы, подразделяющиеся на фазы (рис. 10.6).
Первой фазой митоза является профаза — фаза реорганизации клетки. Разрушается ряд структур, существовавших в клетке до митоза, и строятся новые, связанные с процессом деления. В цитоплазме органоиды смещаются от ядра на периферию клетки. Ядро увеличивается в объеме, хроматин оформляется в хромосомы с кинетохором (определенный участок хромосомы) и с двумя сестринскими хроматидами каждая. Ядрышко постепенно диссоциирует. После распада оболочки ядра на ряд ретикулярных элементов в клетке формируется структура веретена.
В клетках растений нет центриолей (организаторов веретена), характерных для животных клеток. Их функцию выполняют скопления мембран ЭР на полюсах клетки. С ними связаны структурные элементы веретена.
 Веретено включает в себя микротрубочки (МТ) двух типов: а) межполюсные, идущие от полюса к полюсу, составляющие 10% от общего числа МТ; б) многочисленные хромосомные МТ, направленные от кинетохора к полюсу. МТ состоят из субъединиц тубулина (см. 1.1.2). С ними ассоциированы белки, регулирующие сборку МТ. Из нитей веретена выделен также немышечный актин. В кинетохорах хромосом и у полюсов веретена иммуноцитологическими методами выявлена локализация кальмодулина — белка, связывающего кальций и участвующего в разборке МТ.
Веретено включает в себя микротрубочки (МТ) двух типов: а) межполюсные, идущие от полюса к полюсу, составляющие 10% от общего числа МТ; б) многочисленные хромосомные МТ, направленные от кинетохора к полюсу. МТ состоят из субъединиц тубулина (см. 1.1.2). С ними ассоциированы белки, регулирующие сборку МТ. Из нитей веретена выделен также немышечный актин. В кинетохорах хромосом и у полюсов веретена иммуноцитологическими методами выявлена локализация кальмодулина — белка, связывающего кальций и участвующего в разборке МТ.
Для образования структуры веретена могут использоваться ранее существовавшие в цитоплазме МТ, а также МТ, вновь синтезированные из фонда субъединиц тубулинов клетки. В профазе кинетохоры хромосом не связаны с элементами веретена.
В течение следующего периода митоза — прометафазы (метакинеза) начинается движение хромосом. Перед его началом кинетохоры увеличиваются в размерах, от них отходят многочисленные хромосомные МТ. Полагают, что кинетохор участвует в формировании МТ и движениях хромосом. В течение метакинеза хромосомы движутся сначала к полюсам, а затем — к середине веретена. Во время этих перемещений в хромосоме раскручиваются две сестринские хроматиды, которые остаются соединенными в кинетохоре. Повреждение кинетохора в это время избирательным ультрафиолетовым облучением или лазером останавливает движение хромосом.
В результате перемещения хромосомы собираются вдоль поперечника веретена и образуют метафазную пластинку (метафаза). При этом они совершают небольшие перемещения вдоль веретена. В течение метафазы продолжается синтез РНК и белков, хотя и с невысокой скоростью.
Переход клетки к анафазе сопровождается делением кинетохора, физическим разделением двух сестринских хроматид и перемещением разделившихся хромосом к полюсам кинето-хором вперед. Происходит также перераспределение микротрубочек: количество их у полюсов уменьшается и увеличивается в интерполярной области, в районе экватора веретена (см. рис. 10.6). В поперечной плоскости веретена начинает образовываться зона скопления везикул — начало формирования разделительной пластинки.
Перемещения хромосом в анафазе объясняются как участием физических сил (электростатические, электромагнитные, гидродинамические взаимодействия), так и деятельностью биохимических механизмов. Предполагается, что перемещение связано с последовательным отщеплением субъединиц МТ веретена белковой системой, локализованной на поверхности кинетохора. По-видимому, существенны также взаимодействие МТ и микрофиламентов актина, входящего в состав веретена, а также локальные изменения содержания кальция.
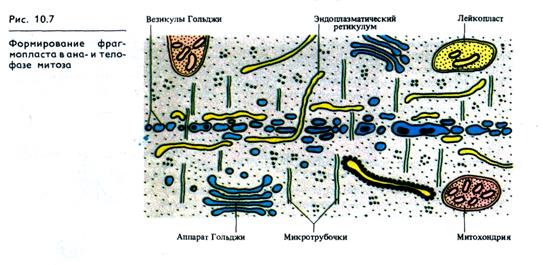
После расхождения хромосом к полюсам начинается последняя стадия митоза — телофаза.
У полюсов МТ веретена дезинтегрируют, образуются ядрышки, ядра, заканчивается формирование разделительной пластинки — фрагмопласта, делящей клетку пополам в экваториальной плоскости. В анафазе вдоль экватора веретена скапливаются пузырьки различного размера (рис. 10.7). Мелкие везикулы являются производными АГ и содержат пектиновые вещества. В экваториальной плоскости обнаруживаются также мембраны ЭР. Для образования фрагмопласта важно также присутствие кальция. Сливаясь, везикулы образуют две мембраны — плазмалеммы дочерних клеток, разделенные полужидким слоем, состоящим из пектиновых веществ. Взаимодействие везикул происходит между микротрубочками веретена.
От центра к периферии фрагмопласт растет за счет присоединения (самосборки) новых пузырьков, но цитоплазма дочерних клеток остается связанной через плазмодесмы, формирующиеся в тех участках клеточной пластинки, в которых оказались локализованными нити веретена с МТ и элементами ЭР. Со стороны цитоплазмы дочерних клеток начинается формирование первичных клеточных стенок, а фрагмопласт превращается в срединную пластинку. Откладывающиеся микрофибриллы целлюлозы первичных клеточных стенок имеют рыхлую текстуру, но основное направление ориентации микрофибрилл перпендикулярно продольной оси клетки. Содержание целлюлозы в первичных клеточных стенках вначале не превышает 2,5%.
Гемицеллюлозы, пектиновые вещества и гликопротеин эк-стенсин доставляются к формирующейся клеточной стенке в везикулах Гольджи, так как именно в диктиосомах АГ происходят концентрирование, первичная полимеризация и мембранная упаковка этих компонентов (рис. 10.8). Синтезированный в гранулярном ЭР полипептид экстенсина гликозилируется затем в диктиосомах АГ. Компоненты ферментного комплекса синтазы целлюлозы локализованы на наружной поверхности плазмалеммы.
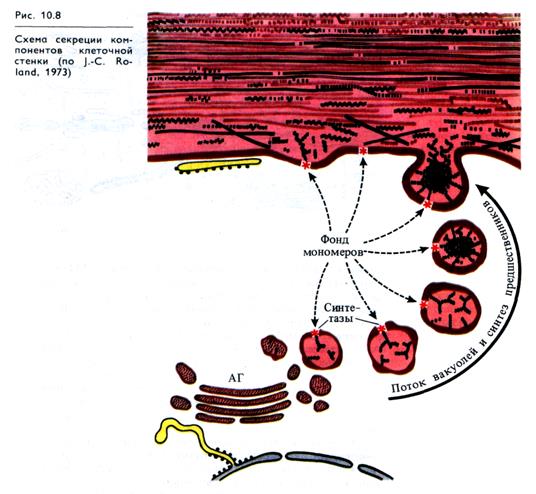
Ферменты, необходимые для сборки полимеров стенки и их модификации, также, по-видимому, доставляются в стенку в везикулах ЭР или АГ. Все компоненты попадают в формирующуюся стенку в результате секреторного процесса. Необходимые для синтеза целлюлозы UDP- и GDP-глюкоза транспортируются из растворимой фазы клетки через плазмалемму, и синтезируемые синтазой целлюлозы молекулы целлюлозы встраиваются в клеточную стенку, которая таким образом утолщается изнутри.
Митотический цикл. После окончания деления дочерние клетки растут благодаря синтезу компонентов цитоплазмы. Именно так растут и животные клетки. Как правило, дочерние клетки достигают размеров материнской и затем могут вновь перейти к делению. Процесс деления (митоз) и период цитоплазматического роста и подготовки к делению (интерфаза) составляют митотический цикл клетки.
 В зависимости от особенностей биохимических процессов различают четыре периода митотического цикла. Собственно митоз — М, пресинтетический период —G1 (от англ, gap — интервал), синтетический период - S и премитотический (постсинтетический) — G2.
В зависимости от особенностей биохимических процессов различают четыре периода митотического цикла. Собственно митоз — М, пресинтетический период —G1 (от англ, gap — интервал), синтетический период - S и премитотический (постсинтетический) — G2.
Период g1 наиболее чувствителен к воздействию факторов внешней среды. Именно в течение этого периода готовятся условия для синтеза ДНК: синтезируются необходимые ферменты, кофакторы, нуклеотиды, входящие в состав ДНК. Одновременно образуются общие белки клетки и часть ее РНК.
Синтетический период характеризуется синтезом ДНК, а также специфических ядерных белков — гистонов. Синтез ДНК прекращается после удвоения ее количества.
В периоде G2 продолжается синтез РНК и общих белков клетки. Резко усиливается синтез тубулина по сравнению с предшествующими периодами. В течение митоза продолжается образование белков и РНК до окончания метафазы.
У растений этапы митотического цикла контролируются гормонами. Для нормального протекания G2- и g1-периодов митотического цикла необходим ауксин, поддерживающий высокий уровень синтеза РНК, белков и высокую интенсивность дыхания. Цитокинин, по-видимому, требуется для перехода клеток к делению.
Следует отметить, что в делящихся клетках происходит также становление структур органоидов (АГ, митохондрий, пла-стидной системы).
Увеличение размера делящихся клеток происходит за счет синтеза структур цитоплазмы и поддерживается поступлением в клетки значительных количеств соединений азота и других питательных веществ. Прекратившие деление клетки многоклеточных растений переходят к более быстрому типу роста — росту растяжением, существующему только у растительных клеток. Он служит важнейшим механизмом, обеспечивающим увеличение площади листовой поверхности, длины стебля и корневой системы, что необходимо для оптимизации процессов питания и других целей. При этом типе роста значительное увеличение объема клеток достигается за счет образования большой центральной вакуоли (см. рис. 1.1). Поглощение воды вакуолью обеспечивается высокой концентрацией осмотически активных веществ в вакуолярном соке. Одновременно с возрастанием объема вакуоли клеточные стенки размягчаются и растягиваются.
 Переход меристематических клеток к растяжению изучен недостаточно. Процесс перехода к растяжению устойчив к действию неблагоприятных факторов: ингибиторы синтеза белка и РНК, высокие дозы рентгеновского облучения этот процесс не останавливают. Закончившие деление меристематические клетки вакуолизируются. Перестраивается белоксинтезирую-щая система: рибосомы, которые в делящихся клетках находились в основном в цитоплазме, в большом количестве присоединяются к мембранам ЭР. В клетках возрастает синтез РНК и увеличивается отношение РНК/белок по сравнению с делящимися клетками. В амилопластах накапливается крахмал, интенсифицируется синтез пектиновых веществ.
Переход меристематических клеток к растяжению изучен недостаточно. Процесс перехода к растяжению устойчив к действию неблагоприятных факторов: ингибиторы синтеза белка и РНК, высокие дозы рентгеновского облучения этот процесс не останавливают. Закончившие деление меристематические клетки вакуолизируются. Перестраивается белоксинтезирую-щая система: рибосомы, которые в делящихся клетках находились в основном в цитоплазме, в большом количестве присоединяются к мембранам ЭР. В клетках возрастает синтез РНК и увеличивается отношение РНК/белок по сравнению с делящимися клетками. В амилопластах накапливается крахмал, интенсифицируется синтез пектиновых веществ.
Механизмы, обусловливающие переход клеток к растяжению, исследованы мало. Предполагается, что большую роль может играть изменение содержания и соотношения фитогормонов и их рецепторов по мере удаления делящейся клетки от инициальных. Выше отмечалось, что для подготовки и перехода клетки к делению необходимо взаимодействие ауксина и ци-токинина. Возможно, переход к растяжению вызывается изменением соотношения концентраций ауксина и цитокинина и их рецепторов в сторону, менее благоприятную для деления и более соответствующую росту растяжением, поскольку для роста растяжением обязательно присутствие ауксина. Таким образом, в клетках меристемы, готовящихся перейти к росту растяжением, создаются механизмы, обеспечивающие процесс растяжения.
Период роста клетки растяжением хорошо изучен. В этот период поддерживается работа уже сформированного механизма растяжения. В клетках высших растений растяжение активируется в основном ИУК (ауксином). Под действием ауксина увеличивается пластическая растяжимость клеточной стенки. Ауксин индуцирует активный транспорт ионов Н+, направленный из цитоплазмы в клеточную стенку. Снижение величины рН в фазе клеточной стенки, возможно, способствует разрыву кислотолабильных связей в ней. Кроме того, подкисление активирует кислые гидролазы и другие ферменты, модифицирующие компоненты клеточной стенки (см. рис. 2.7). Все это приводит к увеличению ее растяжимости. Стенка растягивается благодаря внутриклеточному тургорному давлению, которое поддерживается поступлением воды в растущую вакуоль, где осмотически активные вещества образуются как в результате расщепления полимеров цитоплазмы кислыми гидролазами вакуолей, так и вследствие их поступления из цитоплазмы.
Действие ауксина на рост растяжением сопровождается синтезом РНК, белков и секрецией полисахаридов и белков, необходимых для процесса клеточного растяжения. Рост клеточной стенки обеспечивается активной деятельностью АГ. Везикулы Гольджи поставляют полисахаридные компоненты, а также способствуют увеличению площади цитоплазматической мембраны. Усиливается синтез целлюлозы на наружной поверхности плазмалеммы. Выбор направления роста — удлинение клетки или ее изодиаметрический рост — определяется расположением микрофибрилл целлюлозы в клеточных стенках. Важно отметить, что к действию ауксина наиболее чувствителен эпидермис побегов. Рост внутренних паренхимных тканей сильнее активируется увеличением кислотности, вызванным, например, СО2 в повышенных концентрациях. Усиление роста под действием кислотности (рН 3 — 5) получило название «эффекта кислого роста». Кислотность ускоряет рост лишь в течение
 1 — 3 ч. Этот рост не поддерживается синтезом белков. По-видимому, рост растяжением обусловливается взаимодействием ауксинзависимого и «кислого роста».
1 — 3 ч. Этот рост не поддерживается синтезом белков. По-видимому, рост растяжением обусловливается взаимодействием ауксинзависимого и «кислого роста».
В конце роста растяжением усиливается лигнификация клеточных стенок, накапливаются ингибиторы фенольной природы и абсцизовая кислота, возрастает активность пероксидазы и оксидазы ИУК, снижающая общее содержание ауксина в тканях. Начавшееся формирование вторичной клеточной стенки лишает клетку способности к растяжению. Все эти факторы приводят к торможению и прекращению удлинения клеток.
На всех этапах роста клеток растяжением осуществляется самосборка: работа генетического аппарата, обеспечивающего реализацию программы роста растяжением, взаимодействие ауксина с рецептором, сборка сложных ферментативных комплексов, в частности синтазы целлюлозы, состоящей из многих субъединиц, включение мембран пузырьков Гольджи в состав плазмалеммы растущей клетки, сборка молекул целлюлозы, гемицеллюлоз, пектинов и структурных белков (экстенсина) в клеточных стенках, процессы кристаллизации в микрофибриллах целлюлозы и т. д..
Дифференцировка клеток — это появление качественных различий между ними, связанных с их специализацией. Специализация клеток обеспечивается биохимическими и структурными особенностями, которые позволяют клетке выполнять определенные физиологические или другие функции, необходимые для жизнедеятельности того или иного органа или растения в целом. На рис. 5.11 показано, как меристематические клетки прокамбия превращаются в специализированные сосуды ксилемы, что сопровождается утолщением и лигнификацией вторичных клеточных стенок и отмиранием цитоплазмы.
Некоторые клетки дифференцируются очень рано, уже в апикальной меристеме, например клетки эпидермиса. Большинство других клеток меристемы в верхушках побега и корня делятся и внешне мало отличаются друг от друга. Однако их будущая специализация часто предопределяется (детерминируется) в зоне деления. На это указывают, например, данные о нахождении в меристеме зародышевого корня кукурузы с помощью иммунохимического метода антигенов, характерных для клеток центрального цилиндра. Таким образом, тканеспе-цифические белки появляются в меристеме задолго до созревания проводящих элементов флоэмы и ксилемы.
 В основе качественного различия клеток лежат процессы дифференциальной активности генов. Каждая вегетативная клетка растительного организма в своем геноме содержит полную информацию о развитии всего организма и в определенных условиях может дать начало формированию тех или иных органов или целого растения (свойство тотипотентности). Однако находясь в составе организма, эта клетка будет реализовывать только часть своей генетической информации. Сигналами (эффекторами) для экспрессии той или иной генетической программы служат определенные сочетания фитогормонов, метаболитов и физико-химических факторов. Гипотетическая схема регуляторного действия эффекторов на работу генетического аппарата представлена на рис. 2.3.
В основе качественного различия клеток лежат процессы дифференциальной активности генов. Каждая вегетативная клетка растительного организма в своем геноме содержит полную информацию о развитии всего организма и в определенных условиях может дать начало формированию тех или иных органов или целого растения (свойство тотипотентности). Однако находясь в составе организма, эта клетка будет реализовывать только часть своей генетической информации. Сигналами (эффекторами) для экспрессии той или иной генетической программы служат определенные сочетания фитогормонов, метаболитов и физико-химических факторов. Гипотетическая схема регуляторного действия эффекторов на работу генетического аппарата представлена на рис. 2.3.
 С окончанием процесса дифференцировки клетка вступает в фазу своей зрелости и начинает выполнять те функции, которые заложены в ее организации.
С окончанием процесса дифференцировки клетка вступает в фазу своей зрелости и начинает выполнять те функции, которые заложены в ее организации.
Старение и отмирание - завершающие этапы онтогенеза дифференцированных клеток. Наиболее подробно эти явления изучены у стареющих листьев и лепестков цветков.
Для стареющих клеток характерно ослабление синтетических и усиление гидролитических процессов. Наблюдается снижение содержания РНК и белков, возрастает активность гидролаз, пероксидазы, усиливается окисление липидов мембран, в органоидах и цитоплазме увеличивается количество липидных капель. Снижается полупроницаемость мембран и увеличивается потеря веществ клеткой. В органоидах и цитоплазме образуются автофагические вакуоли, набухает и фрагментируется ЭР. На последней стадии старения разрушаются хлорофилл и хлоропласты, диссоциируют ЭР и АГ, набухают митохондрии, в них снижается число крист, вакуолизируется ядро, разрушается ядрышко. Старение становится необратимым с момента разрушения тонопласта и выхода его содержимого (в том числе кислых гидролаз) в цитоплазму.
Существуют две группы гипотез, объясняющих механизмы старения на клеточном и молекулярном уровнях:
1. Накопление повреждений в генетическом аппарате, в мембранах и в других структурах, увеличение концентрации ядовитых веществ в клетке.
2. Включение генетической программы старения как последнего этапа онтогенеза.
Обе гипотезы имеют достаточно убедительные обоснования. Например, ингибиторы синтеза белков (циклогексимид и др.) тормозят распад внутриклеточных структур, очевидно, угнетая синтез гидролаз. С другой стороны, в ходе онтогенеза в клетках возрастает количество поломок, несмотря на постоянное самообновление всех структур и систему репарации днк.
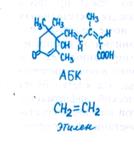
Причину старения клеток можно лучше понять, исходя из физиологии целого растения. Уменьшение поступления в клетки того или иного органа некоторых фитогормонов (ауксина, цитокинина, гиббереллина) и питательных веществ резко ускоряет процессы старения (см. 2.5). Обработка же тканей изолированных листьев цитокинином, ауксином и гиббереллином активирует синтез белков, восстанавливает структуру хлоропла-стов. В этих условиях даже изолированный лист, который начал желтеть, снова зеленеет и становится способным к интенсивному фотосинтезу. Фитогормоны-активаторы индуцируют синтез РНК и белков, необходимых для функциональной активности клеток. Наоборот, этилен и АБК ускоряют процессы старения. Содержание этих фитогормонов в стареющих клетках возрастает.
Один из существенных признаков старения клетки — сдвиг
величины рН в цитоплазме в кислую сторону. Это неблагоприятно сказывается на физико-химическом состоянии белков и способствует активации кислых гидролаз. Удаление ионов Н+ из цитоплазмы в окружающую среду и в центральную вакуоль защищает внутриклеточные структуры от деградации. Ауксин, активирующий работу Н+- помпы, тем самым защищает цитоплазму от закисления.
Ослабление или отказ Н+- помпы, потеря мембранами свойств полупроницаемости приводят к утрате клеткой неравновесного состояния (мембранного потенциала), к неспособности поглощать и удерживать вещества. С этого момента клетка перестает быть живой и лизирует.
Важнейшим этапом формирования внутриклеточных структур являются процессы транскрипции и трансляции, приводящие к синтезу белков, способных, как и липиды, участвовать в самосборке клеточных компонентов (мембран, рибосом, полисом, микротрубочек, микрофи-ламентов и др.). Самосборка основывается на слабых взаимодействиях и характеризуется избирательностью, комплементарностью, самопроизвольностью и обратимостью. Биогенез хлоропластов и митохондрий включает в себя как элементы обновления и самосборки мембран, так и размножение путем деления органоидов с последующей дифференцировкой внутренних мембранных структур.
Процессы самосборки осуществляются в течение всего жизненного цикла клетки, которая проходит этапы деления, роста растяжением, дифференцировки, старения и смерти. У делящихся растительных клеток нет центриолей, функцию которых выполняют скопления ретикулярных элементов. Деление клетки происходит благодаря образованию фрагмопласта (срединной пластинки). Для растений характерен рост клеток растяжением, механизм которого состоит в образовании большой центральной вакуоли и в размягчении и растяжении клеточной стенки.

Г л а в а 11
 2015-05-26
2015-05-26 5552
5552
