Тема «Дисперсные системы. Растворы»
Вопросы теории.
- Понятие о дисперсных системах. Классификация дисперсных систем.
- Способы выражения концентраций истинных растворов.
- Механизм растворения твёрдого вещества.
- Электролитическая диссоциация. Константа и степень диссоциации. Сильные и слабые электролиты.
- Понятие об ионной силе растворов. Активная концентрация электролита.
- Ионное произведение воды. рН растворов.
- Гидролиз солей.
- Произведение растворимости (ПР) малорастворимых веществ.
- Коллоидные растворы.
Лабораторная работа № 5
Тема. Дисперсные системы. Растворы.
Ι. Теоретическая часть.
Ι.1. Понятие о дисперсных системах
Дисперсные системы – это системы, состоящие из двух или более веществ, в которой одно или несколько веществ измельчено (распределено) в основном веществе.
Дисперсная фаза – частицы измельчённого вещества.
Дисперсная среда – вещество, в котором распределены частицы измельчённого вещества.
Пример: водный раствор поваренной соли (дисперсная фаза - поваренная соль, дисперсная среда – вода).
|
|
|
Ι.2. Классификация дисперсных системах
1. Молекулярно – дисперсные системы – это гомогенные системы, где частицы измельчены до размеров молекул и ионов. Это истинные растворы. Прозрачные. (Диаметр частиц дисперсной фазы – 10-10 – 10-8 м).
Пример: раствор сульфата меди.
2. Тонкодисперсные системы – это микрогетерогенные системы. Коллоидные растворы. Мутные. Для данных систем характерен эффект Тиндаля. (Диаметр частиц дисперсной фазы – 10-7 – 10-6 м).
Пример: раствор гидроксида алюминия.
3. Грубодисперсные системы – это макрогетерогенные системы. (Диаметр частиц дисперсной фазы – 10-5 – 10-5 м).
Пример: суспензии, пены, дымы, аэрозоли.
Ι.3. Способы выражения концентрации вещества в растворе.
Молярная концентрация – это количество растворённого вещества в 1 л раствора.
 СМ раствора =
СМ раствора = 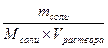
[СМ раствора] = [моль/л].
Молярная концентрация эквивалента (нормальность) – число моль – эквивалентов растворённого вещества в 1 л растворе.
Сн раствора = 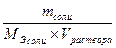
[Сн раствора] = [моль/л];
Mэ соли – молярная масса эквивалента соли (Ktn z +Anm), где n – число катионов в соли, (z+) – заряд катиона.
Mэ соли = 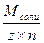
Моляльная концентрация – число моль растворённого вещества в 1 кг растворителя.
Сm раствора = 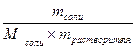
[Сm раствора] = [моль/кг];
m растворителя = (m раствора - m соли) = (V раствора * ρ раствора - m соли)
Титр раствора – отношение массы растворённого вещества (г) к объёму (мл) раствора.
Т = m соли / V раствора;
[Т]=[г/мл].
Ι.4. Ионное произведение воды. Водородный показатель.
Вода – очень слабый амфотерный электролит. Процесс электролитической диссоциации воды можно выразить уравнениями:
|
|
|
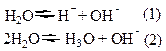
Применим к равенству (1) закон действия масс. Получим:
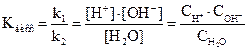 ,
,
где С – концентрации воды и ионов соответственно, Кдисс – константа диссоциации воды.
Т.к. константа диссоциации для воды является величиной постоянной, то произведение 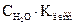 тоже постоянная величина, которая называется ионным произведением воды:
тоже постоянная величина, которая называется ионным произведением воды:
[H+].[OH-]=Kw
При температуре 250С Kw=10-14;
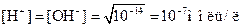 .
.
Для простоты расчетов принято обозначать характер среды раствора десятичным логарифмом от концентрации ионов водорода [H+], взятым с обратным знаком. Этот обратный логарифм lg[H+] называется водородным показателем и обозначается рН:
pH=- lg[H+].
Соответственно: 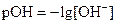
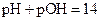
Следовательно, водородный показатель рН принимает значения от 1 до 14: в кислой среде рН < 7; в щелочной среде рН > 7; в нейтральной среде pH=7.
Ι.5. Гидролиз солей
Гидролизом соли называется взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и изменению рН раствора.
Вода диссоциирует на ионы Н+ и ОН-, находящиеся в равновесии с огромным числом недиссоциированных молекул, которые могут служить источником ионов, если это равновесие будет нарушено. Это нарушение может произойти в результате связывания одного из ионов воды с гидролизующимся веществом и привести к накоплению в растворе другого иона, вследствие чего раствор приобретает кислую или щелочную реакцию.
Типы солей
| основание | Кислота | |
| сильная | слабая | |
| сильное | 1-й тип солей NaCl Ca(NO3)2 | 2-й тип солей Na2CO3 KCN |
| слабое | 3-й тип солей NH4Cl Al2(SO4)3 | 4-й тип солей Al2S3 ZnCO3 |
Гидролизу подвергаются только те соли, в состав которых входят или ионы слабой кислоты, или ионы слабого основания, т.е. 2-й, 3-й и 4-й типы солей.
| 1-й тип солей | 2-й тип солей | 3-й тип солей | 4-й тип солей | ||||
| Na | Cl | Na2 | CO3 | NH4 | Cl | Al2 | S3 |
| Сильное основание | Сильная кислота | Сильное основание | Слабая кислота | Слабое основание | Сильная кислота | Слабое основание | Слабая кислота |
| OH- | H+ | OH- | H+ | ||||
| pH=7 | рН > 7, среда щелочная | рН < 7, среда кислая | pH≈7 | ||||
| Гидролиз не идёт | Гидролиз идёт (по аниону) | Гидролиз идёт (по катиону) | Гидролиз идёт (и по катиону, и по аниону) |
Алгоритм написания уравнений гидролиза.
На примере гидролиза соли CuCl2.
- Определить к какому типу относится соль (каким основанием и какой кислотой образована). Сделать предположение о возможности протекания гидролиза данной соли.
| 3-й тип солей | |
| Сu | Cl2 |
| Слабое основание | Сильная кислота |
| H+ | |
| рН < 7, среда кислая | |
| Гидролиз идёт (по катиону) |
Записать уравнение гидролиза по I ступени:
Запись:
I.CuCl2+HOH→
Слаб.Сильн.
осн-е к-та
- Записать соль в ионном (диссоциированном) виде. Поставить ионы в молекуле воды.
Запись:
I. CuCl2+HOH→
Слаб.Сильн.
осн-е к-та
Cu2++ 2Cl-+H+OH-→
Слаб.
осн-е
- Обозначить замкнутой линией взаимодействие ионов слабого электролита с противоположным по знаку ионом воды.
Запись:
I. CuCl2+HOH→
Слаб.Сильн.
осн-е к-та

Cu2++ 2Cl-+H+OH-→
Слаб..
Осн-е
- Записать прочное соединение (слабый электролит) образованное в результате взаимодействия ионов слабого электролита с противоположным по знаку ионом воды. Определить суммарный заряд полученного прочного соединения. Дописать оставшиеся частицы.
Запись:
I. CuCl2+HOH→
Слаб.Сильн.
осн-е к-та

Cu2++ 2Cl-+H+OH-→ CuOH+ + 2Cl-+H+,
Слаб..
Осн-е
- Определить pH среды. (Если в результате взаимодействия ионов слабого электролита с ионом воды образовались H+, то pH < 7, среда кислая; если в результате взаимодействия - образовались OH-, то рН > 7 в щелочной среде).
Запись:
I. CuCl2+HOH→
Слаб.Сильн.
осн-е к-та

Cu2++ 2Cl-+H+OH-→ CuOH+ + 2Cl-+ H+, pH < 7, среда кислая;
Слаб.
Осн-е
Получили уравнение гидролиза в полном ионном виде.
- Записать уравнение в молекулярном виде: из противоположно заряженных частиц, образованных в ионном уравнении, получить нейтральные молекулы и записать их в первое уравнение.
Запись:
|
|
|
I. CuCl2+HOH→CuOHCl + HCl, pH < 7, среда кислая;
Слаб.Сильн.
осн-е к-та


 Cu2++ 2Cl-+H+OH-→ CuOH+ + 2Cl-+ H+, pH < 7, среда кислая;
Cu2++ 2Cl-+H+OH-→ CuOH+ + 2Cl-+ H+, pH < 7, среда кислая;
Слаб.
Осн-е
- Записать уравнение в сокращённом ионном виде: в обеих частях уравнения вычеркнуть подобные частицы.
Запись:
I. CuCl2+HOH→CuOHCl + HCl, pH < 7, среда кислая;
Слаб.Сильн.
осн-е к-та
 | |||
 | |||

 Cu2++ 2Cl-+H+OH-→ CuOH+ + 2Cl-+ H+, pH < 7, среда кислая;
Cu2++ 2Cl-+H+OH-→ CuOH+ + 2Cl-+ H+, pH < 7, среда кислая;
Слаб..
Осн-е
Cu2++ HOH→ CuOH+ + H+, pH < 7, среда кислая.
Слаб.
Осн-е
- Записать уравнение гидролиза по II ступени:
Запись:
II. CuOHCl +HOH→
Слаб.Сильн.
осн-е к-та
- Записать соль в ионном (диссоциированном) виде. Поставить ионы в молекуле воды.
Далее действия 3-7.
Запись:
II. CuOHCl +HOH→ Сu(OH)2↓+ H Cl, pH < 7, среда кислая.
Слаб.Сильн.
осн-е к-та
 | |||
 | |||
CuOH++ Cl-+H+OH-→Сu(OH)2↓+ Cl-+ H+, pH < 7, среда кислая.
Слаб.
Осн-е.
CuOH+ +HOH→ Сu(OH)2↓+ H +, pH < 7, среда кислая.
 Слаб.
Слаб.
Осн-е.
Суммарное уравнение гидролиза:
CuCl2+HOH→Cu(OH)2↓+ HCl, pH < 7, среда кислая.
Слаб.Сильн.
осн-е к-та
ΙΙ. Экспериментальная часть.
Опыт 5.1. Приготовление раствора соли определённой массовой концентрации (ω, %).
Цель: Приготовить раствор соли определённой массовой концентрации (ω, %). Рассчитать молярную, нормальную, моляльную концентрации и титр раствора.
Приготовить раствор соли объёмом 200 мл (V раствора).
| вариант | соль | ω, % | ρ, г/мл |
| NaCl | 1,014 | ||
| KCl | 1,030 | ||
| Al2(SO4)3 | 1,040 | ||
| Na2SO4 | 1,061 | ||
| Na2SO4 | 1,083 | ||
| NH4Cl | 1,020 | ||
| NaCl | 1,058 | ||
| NH4Cl | 1,029 | ||
| Al2(SO4)3 | 1,105 | ||
| NaOH | 1,043 | ||
| Al2(SO4)3 | 1,050 | ||
| NaOH | 1,065 | ||
| NaCl | 1,051 | ||
| KCl | 1,056 | ||
| Na2SO4 | 1,082 |
Ход работы:
1.Взвесить на технических весах навеску соли массой m соли.
Расчёт массы соли:
ω = m соли / m раствора* 100 %;
m раствора = V раствора * ρ раствора;
m соли = ω * m раствора / 100 %;
m соли = ω * V раствора * ρ раствора / 100 %.
2. Поместить навеску соли в мерную колбу.
|
|
|
3. Долить дистиллированную воду в мерную колбу до метки (риски).
4. Закрыть колбу пробкой.
5. Полученный раствор перемешать.
В отчёте:
- Рассчитайте массу соли необходимую для приготовления раствора с определённой массовой концентрацией.
- Опишите процесс приготовления растворов с определённой массовой концентрацией. Зарисуйте мерную колбу.
- Используя данные формулы, рассчитайте молярную, нормальную, моляльную концентрации и титр раствора.
 2015-06-14
2015-06-14 2635
2635
