591. Электролитами называются вещества, диссоциирующие в растворе. Согласно теории электролитической диссоциации, кислоты- вещества, которые при диссоциации дают катионы водорода. Основания при диссоциации дают ОН-группы. Соли диссоциируют на катион и анион кислотного остатка. Кислые и основные соли называют промежуточными соединениями, т.к. они являются продуктами неполной реакции нейтрализации.
592. Возможность электролитической диссоциации определяется природой вещества (сильный или слабый электролит), природой растворителя, температурой и т.п. Ионизирующую силу растворителя характеризует диэлектрическая проницаемость: вода – 81.0, спирт – 25.8, бензол – 2.23, фтороводород – 32.3. Диссоциация NaCl:
NaCl + H2O =  |
593. В воде хлорид натрия диссоциирует на ионы практически полностью, а спирт практически не диссоциирует. Т.к. ионы, образующиеся при диссоциации, проводят электрический ток, то раствор NaCl проводит электрический ток, а раствор CH3CH2OH не проводит.
594. Для количественной характеристики электролитической диссоциации применяются константа диссоциации (Кд) и степень диссоциации (а). Кд – отношение произведения концентраций продуктов к произведению концентраций исходных веществ. а – отношение количества диссоциированных молекул к исходному количеству молекул. Постоянной величиной при различных концентрациях является Кд.
595. По величине электролитической диссоциации электролиты делятся на: сильные (Кд >>1), средние (1> Кд > 10-2) и слабые (Кд << 1). К первым относится HNO3(Кд = 43.6): HNO3 = H+ + NO3- . Ко вторым – HIO4 (Кд = 2/3*10-2): HIO4 = H+ + IO4-. К слабым электролитам относят NH4OH (Кд = 1.76*10-5): NH4OH = NH4+ + OH-.
596.
| K2SO4↔ K+ + KSO4-1 KSO4-1 ↔ K+ + SO4-2 | K1 = 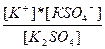 K2= K2= 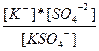 |
| Ca(OH)2 ↔ Ca2+ + 2OH - | K = 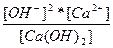 |
| H3PO4 ↔ 3H+ + PO43- | K = 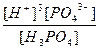 |
| KHCO3 ↔ K+ + H+ + CO32- | K = 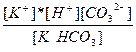 |
| 3H+ + AlO3-3↔Al(OH)3 ↔ Al3+ + 3OH- | K = 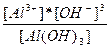 |
| Fe(OH)Cl2 ↔ Fe2+ + OH - + 2Cl - | K = 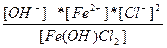 |
597.
| Ba(OH)2 ↔ Ba+2 + 2OH- | K = 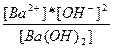 |
| H3AsO4 ↔ 3H+ + AsO4-3 | K = 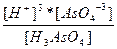 |
| KHSO4 ↔ K+ + HSO4 – HSO4 – ↔ H+ + SO4 –2 | K 1= 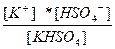 K 2= K 2= 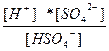 |
| Fe(OH)2Cl ↔ Fe3+ + 2OH- + Cl- | K = 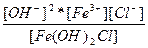 |
| 2H+ + ZnO22-↔Zn(OH)2 ↔ Zn2+ + 2OH- | K = 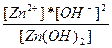 |
598.
| Сa(NO3)2 ↔ Ca+2 + 2NO3- | K = 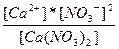 |
| Sr(OH)2 ↔ Sr+2 + 2OH- | K = 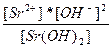 |
| NaH2PO4 ↔ Na+ + H2PO4 – H2PO4 – ↔ 2H+ + PO4 –3 | K 1= 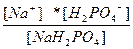 K 2= K 2= 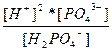 |
| 2H+ + BeO22-↔Be(OH)2 ↔ Be+2 + 2OH- | K = 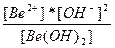 |
| AlOH(NO3)2 ↔ Al3+ + OH- + 2NO3- | K = 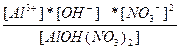 |
599.
| K2Cr2O7 ↔ 2K+ + Cr2O72- | K = 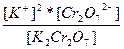 |
| H2SeO3 ↔ 2H+ + SeO32- | K = 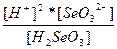 |
| NaHS ↔ Na+ + HS- HS- = H+ + S2- | K1 = 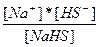 K2 = K2 = 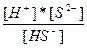 |
| Al(OH)2NO3 ↔ Al3+ + 2OH- + NO3- | K = 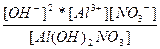 |
| 2H+ + SnO22-↔Sn(OH)2 ↔ Sn2+ + 2OH- | K = 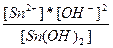 |
600.
| LiOH ↔ Li+ + OH- | K = 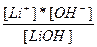 |
| H2S ↔ H+ + HS- HS- ↔ H+ + S2- | K1 = 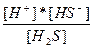 K2 = K2 = 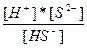 |
| K2HPO4 ↔ 2K+ + H+ + PO43- | K = 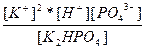 |
| Cr(OH)2Cl ↔ Cr3+ + 2OH- + Cl- | K = 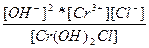 |
| 4H+ + SnO44-↔Sn(OH)4 ↔ Sn4+ + 4OH- | K = 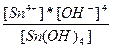 |
601. Тип диссоциации гидроксида зависит от соотношения энергии связи металл-кислород и кислород-водород. В NaOH радиус атома натрия относительно большой, поэтому энергия связи Na-O ниже O-H и он диссоциирует по типу основания Na-O-H = Na+ + OH-; В HNO3 радиус атома азота относительно небольшой, поэтому энергия связи N-O выше O-H и он диссоциирует по типу кислоты H-O-NO2 = H+ + NO3- ; В Zn(OH)2 радиус атома цинка средний между азотом и натрием, поэтому энергии связи Zn-O и O-H примерно равны, в результате соединение диссоциирует и по типу кислоты и по типу основания Zn2+ + 2OH- = Zn(OH)2 = 2H+ + ZnO22-. В сильно кислой среде азотная кислота способна проявлять основные свойства: H-O-NO2 = ОH- + NO2+.
602. Сила кислоты определяется константой ее диссоциации. Чем сильнее диссоциирует кислота, тем сильнее кислота. Чем слабее связь атома водорода с атомом кислорода в молекуле кислоты, тем сильнее кислота. Чем выше степень окисления центрального атома в однотипных кислотах, тем сильнее кислота. Чем больше атомов кислорода, связанных только с центральным атомом приходится на атомы водорода, тем сильнее кислота.
| А) HNO2 – HNO3 | Сила HNO3 выше, т.к. степень окисления азота в ней +5, а в HNO2 cтепень окисления азота +3 |
| Б) H2SO4 – H2SeO4 | Радиус атома Se больше радиуса атома S, поэтому связь Н-О в серной кислоте слабее связи Н-О в селеновой кислоте, т.е. серная кислота сильнее селеновой. |
| В) HPO3 – H3PO4 | Т.к. в HPO3 количество атомов кислорода, связанных только с центральным атомом, приходящихся на атомы водорода, больше, чем в H3PO4, то сильнее HPO3. |
603. Сила кислоты определяется константой ее диссоциации. Чем сильнее диссоциирует кислота, тем сильнее кислота.
| А) HF – HCl – HBr – HI | В данном ряду сила кислот увеличивается от HF к HI, т.к. с ростом радиуса атома галогена связь галоген–водород ослабевает и кислота легче диссоциирует: HCl = H+ + Cl- |
| Б) HClO4 – HClO3 – HClO2 – HClO | Согласно правилу, чем больше атомов кислорода, связанных только с центральным атомом приходится на атомы водорода, тем сильнее кислота. Поэтому в данном ряду сила кислот уменьшается. HClO = H+ + ClO- |
| В) HClO – HBrO – HIO | С ростом радиуса атомов галогенов от Cl к I ослабевает связь галоген-кислород, т.е. увеличивается константа диссоциации по основному типу. Следовательно, сила кислот уменьшается. HBrO = H+ + BrO- |
| Г) HPO3 – H4P2O7 – H3PO4 | Как и в случае (б), в данном ряду количество атомов кислорода, связанных только с центральным атомом слева направо уменьшается, следовательно уменьшается сила кислот. H3PO4 = 3H+ + РО43- |
604. Чем слабее связь Ме—ОН в основании, тем выше сила основания. Т.е., чем больше радиус атома металла, чем меньше степень окисления металла, чем меньше поляризующая способность катиона металла, тем сильнее соответствующее основание. Т.о., в ряду LiOH-…-CsOH сила оснований увеличивается (растет радиус металла), Fe(OH)2 сильнее, чем Fe(OH)3 (степень окисления железа +2 и +3), Ca(OH)2 сильнее, чем Zn(OH)2 (поляризующая способность кальция меньше, чем цинка).
605. 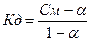 , поскольку величина константы диссоциации небольшая, то степенью диссоциации - а по сравнению с 1 в знаменателе можно пренебречь, тогда
, поскольку величина константы диссоциации небольшая, то степенью диссоциации - а по сравнению с 1 в знаменателе можно пренебречь, тогда 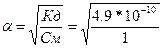 = 2.2*10-5.
= 2.2*10-5.
606.
| Дано: a1 = 0.42 %, С1= 1М a2 = 1.33 %, С2= 0.1М a3 = 4.22%, С3= 0.01М Кд -? | 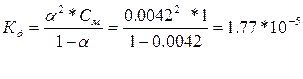 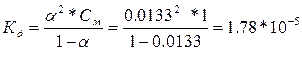 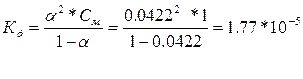 С увеличением разбавления возрастает степень диссоциации, а константа диссоциации остается неизменной, т.е. она не зависит от концентрации раствора. С увеличением разбавления возрастает степень диссоциации, а константа диссоциации остается неизменной, т.е. она не зависит от концентрации раствора. |
607.
| Дано: a = 0.1 % См= 1М. Кд -? | 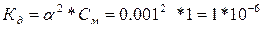 По справочным данным данная Кд относится к NH4OH. По справочным данным данная Кд относится к NH4OH. |
608.
| Дано: Кд1 = 1.3*10-2 Кд2 = 0.6*10-7 См= 0.1м | А) H2S = H+ +HS- 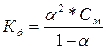 = 1.3*10-2 = = 1.3*10-2 = 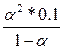 , следовательно, α1=0.3=30% См(HS-) = α1*См(H2S) = 0.3*0.1 = 0.03 моль/л Б) HS- = H+ + S2- = , следовательно, α1=0.3=30% См(HS-) = α1*См(H2S) = 0.3*0.1 = 0.03 моль/л Б) HS- = H+ + S2- = 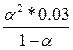 = 0.6*10-7, следовательно, α2 = 0.0014 = 0.14% = 0.6*10-7, следовательно, α2 = 0.0014 = 0.14% |
609.
| Дано: Кд = 1.8*10-5 См1 = 0.1 м См2 = 0.001 м | Закон Оствальда: 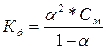 А) 1.8*10-5 = А) 1.8*10-5 = 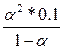 , a1 = 0.0134 Б) 1.8*10-5 = , a1 = 0.0134 Б) 1.8*10-5 = 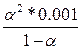 , a2 = 0.134 a2/a1 = 10 раз , a2 = 0.134 a2/a1 = 10 раз |
610. В растворе сильные электролиты диссоциируют нацело, образуя ионы. Т.к. молекулы воды полярны, то они окружают ионы электролита, что приводит к кажущемуся уменьшению концентрации и степени диссоциации электролита.
| Дано: Cm(KCl) = 1моль/кг Т(зам) = -3.360С i, a(каж) =? | 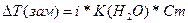 = i*1.86*1 = 3.36, следовательно, i = 1.8 a(каж) = (i-1)/(m-1) = (1.8-1)/(2-1) = 0.8 = 80% = i*1.86*1 = 3.36, следовательно, i = 1.8 a(каж) = (i-1)/(m-1) = (1.8-1)/(2-1) = 0.8 = 80% |
611. В растворе сильные электролиты диссоциируют нацело, образуя ионы. Т.к. молекулы воды полярны, то они окружают ионы электролита, что приводит к кажущемуся уменьшению концентрации и степени диссоциации электролита. Т.к. раствор глюкозы См = 0.44м изотоничен раствору NaCl Сн = 0.25м, то изотонический коэффициент i = 0.44/0.25 = 1.76. Степень диссоциации 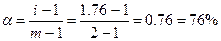 , где m – число ионов, на которые диссоциирует электролит.
, где m – число ионов, на которые диссоциирует электролит.
612. В растворе сильные электролиты диссоциируют нацело, образуя ионы. Т.к. молекулы воды полярны, то они окружают ионы электролита, что приводит к кажущемуся уменьшению концентрации и степени диссоциации электролита.
| Дано: m(NH4Cl) = 1.07 г V(H2O) = 200 мл. Т(кип) = 100.09 0С a(каж) =? | 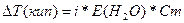 . Найдем моляльность раствора Сm = =n(NH4Cl)/m(H2O) = . Найдем моляльность раствора Сm = =n(NH4Cl)/m(H2O) = 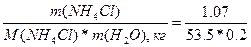 = 0.1 моль/кг 0.09 = i*0.52*0.1 => i = 1.73 a(каж) = (i-1)/(m-1) = (1.73-1)/(2-1) = 0.73 = 73%, где m – количество ионов, на которые диссоциирует электролит. = 0.1 моль/кг 0.09 = i*0.52*0.1 => i = 1.73 a(каж) = (i-1)/(m-1) = (1.73-1)/(2-1) = 0.73 = 73%, где m – количество ионов, на которые диссоциирует электролит. |
613. В растворе сильные электролиты диссоциируют нацело, образуя ионы. Т.к. молекулы воды полярны, то они окружают ионы электролита, что приводит к кажущемуся уменьшению концентрации и степени диссоциации электролита.
| Дано: Р0 = 101.3 кПа V(H2O) = 450 мл n(Na2SO4) = 0.05моль P’ = 100.8 кПа a(каж) =? | Po - P’ = i*P0*N(Na2SO4) n(H2O) = m/M = 450/18 = 25 моль. 101.3 – 100.8 = 101.3*i* 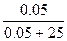 , следовательно, i = 2.47 a(каж) = (i-1)/(m-1) = (2.47-1)/(3-1) = 0.73 = 73 %, где m – количество ионов, на которые диссоциирует электролит. , следовательно, i = 2.47 a(каж) = (i-1)/(m-1) = (2.47-1)/(3-1) = 0.73 = 73 %, где m – количество ионов, на которые диссоциирует электролит. |
614.
| Дано: Cм(Х) = 0.04моль/л Т = 00С = 273 К Pосм = 217.8 кПа А = 70% m =? | Pосм = iСм(Х)*R*T = i*0.04*8.31*273 = 217.8 кПа i = 2.4 Степень диссоциации а = (i-1)/(m-1) = 0.70, следовательно, m = 3. Вещество диссоциирует на три иона. Примеры электролитов: CaCl2, H2SO4 и т.д. |
615. Теоретически i=2,a=100 %, Тзам.= -3.720 С, практически Тзам.= -3.360 С, m = 1моль/кг.
В растворе KCl диссоциирует на ионы: KCl = K+ + Cl-. Полярные молекулы воды окружают эти ионы, что приводит к кажущемуся изменению концентрации. a(практич.) = (3.36/3.72)*100% = 90%. i=1 + (n-1)* a = 1+(2-1)*0.9 = 1.9
616.
| Na2[Sn(OH)6] = 2Na+ + [Sn(OH)6]2- | Кд = 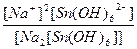 | Кн = 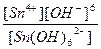 |
| [Cr(NH3)6](NO3)3 = [Cr(NH3)6]3+ + 3NO3- | Кд = 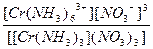 | Кн = 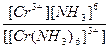 |
617.
| K2[NiCl4] = 2K+ + [NiCl4]2- | Кд = 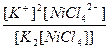 | Кн = 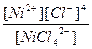 |
| [PtF2(NH3)4](NO3)2 = [PtF2(NH3)4]2+ + 2NO3- | Кд = 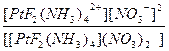 | Кн = 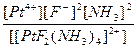 |
618.
| (NH4)2[RuCl6] = 2NH4+ + [RuCl6]2- | Кд = 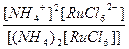 | Кн = 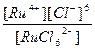 |
| [Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl- | Кд = 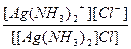 | Кн = 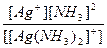 |
619.
| Na2[Ni(CN)4] = 2Na+ + [Ni(CN)4]2- | Кд = 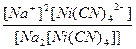 | Кн = 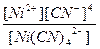 |
| [PtCl2(NH3)4]SO4 = [PtCl2(NH3)4]2+ + SO42- | Кд = 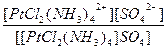 | Кн = 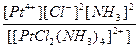 |
620.
| K3[CoF6] = 3K+ + [CoF6]3- | Кд = 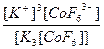 | Кн = 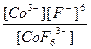 |
| [Fe(NH3)6](NO3)2 = [Fe(NH3)6]2+ + 2NO3- | Кд = 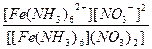 | Кн = 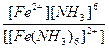 |
 2015-06-16
2015-06-16 2171
2171
