Используя зависимость давления от концентрации и температуры, можно найти связь между макроскопическими параметрами газа – объемом, давлением и температурой. 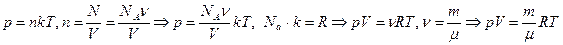 . Это уравнение называют уравнением состояния идеального газа (уравнение Менделеева-Клапейрона).
. Это уравнение называют уравнением состояния идеального газа (уравнение Менделеева-Клапейрона).
Изотермическим процессом называется процесс, протекающий при постоянной температуре. Из уравнения состояния идеального газа следует, что при постоянной температуре, массе и составе газа произведение давления на объем должно оставаться постоянным. Графиком изотермы (кривой изотермического процесса) является гипербола. Уравнение 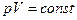 называют законом Бойля-Мариотта.
называют законом Бойля-Мариотта.
Изохорным процессом называется процесс, протекающий при неизменном объеме, массе и составе газа. При этих условиях 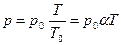 , где
, где 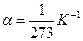 – температурный коэффициент давления газа. Это уравнение называется законом Шарля. График уравнения изохорного процесса называется изохорой, и представляет из себя прямую, проходящую через начало координат.
– температурный коэффициент давления газа. Это уравнение называется законом Шарля. График уравнения изохорного процесса называется изохорой, и представляет из себя прямую, проходящую через начало координат.
Изобарным процессом называется процесс, протекающий при неизменном давлении, массе и составе газа. Аналогичным образом как и для изохорного процесса можно получить уравнение для изобарного процесса 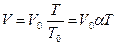 . Уравнение, описывающее этот процесс, называется законом Гей-Люссака. График уравнения изобарного процесса называется изобарой, и представляет из себя прямую, проходящую через начало координат.
. Уравнение, описывающее этот процесс, называется законом Гей-Люссака. График уравнения изобарного процесса называется изобарой, и представляет из себя прямую, проходящую через начало координат.
|
|
|
Относительной молекулярной массой (или атомной) массой вещества Mr называют отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода m0C.
Количеством вещества ν называют отношение числа молекул N в данном теле к числу атомов Na в 12 г углерода.
Постоянная Авогадро – число молекул или атомов в моле вещества. 6,02*1023.
Молярной массой называют массу вещества, взятого в количестве одного моля.
Тепловое движение – беспорядочное движение молекул.
Броуновское движение – это беспорядочное движение частиц твёрдого вещества внутри жидкости.
Температура – мера средней кинетической энергии частиц, мера нагретости тела.
Идеальный газ – физическая модель, в которой ограниченное число молекул движутся без взаимодействия.
Изопроцесс – это процесс изменения системы при одном неизменном параметре.
Основное положение МКТ -
1) Ν=m/M=N/Na – количество вещества;
2) m0=M/Na – масса одной молекулы;
3) T=t+273 – связь температур;
4) Ēср = 3/2kT – связь энергии и температуры;
5) p=1/3m0nŪ2 – основное уравнение МКТ;
6) p=nRT – связь давления и температуры;
7) p=1/3ρŪ2 – связь давления и плотности;
8) p=2/3nĒ – связь давления и энергии;
9) N=m/M•Na – количество молекул;
10) pV=m/M•RT – уравнение Менделеева – Клайперона;
|
|
|
11) pV/T=const – уравнение Клайперона;
12) pV=const – закон Бойля-Мариотта;
13) p/T=const – закон Шарля;
14) V/T = const – закон Гей-Люсака;
15) Ū=√3RT/M – средняя квадратичная скорость молекулы.
 2015-06-05
2015-06-05 2311
2311
