Эмпирические формулы дают информацию о качественном и количественном составе соединений. Взаимное расположение атомов в молекуле вещества отражают структурно-графические формулы, однако они не показывают пространственное расположение атомов.
При составлении структурно-графических формул можно руководствоваться следующими правилами:
1. Элементы соединяются в соответствии с их валентностью.
2. Черточка в формуле обозначает единичную химическую связь, количество черточек соответствует валентности, например:
K2O записывается так: K‑O ‑K.
3. Состав кислот и оснований следует начинать изображать с центрального атома,
| например - Ca(OH)2 H4SiO4 | 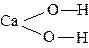 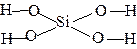 |
4. Если в молекуле кислоты содержится больше атомов кислорода, чем водорода, то «избыточные» атомы кислорода соединены с центральным атомом двойной связью,
| например: HClO4 | 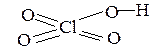 |
5. При написании графических формул солей исходят из графических формул кислот, заменяя атомы водорода на атомы металла, учитывая его валентность, например:
| Na3PO4 | 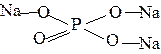 | Fe2(SO4)3 | 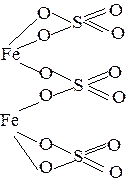 |
| KHCO3 | 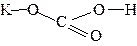 | ||
| CaOHNO3 | 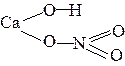 |
Структурно-графические формулы некоторых кислот приведены в табл. 5.
2.4. Общие химические свойства основных классов
неорганических веществ
Оксиды ‑ вещества, состоящие из атомов двух элементов, один из которых – кислород в степени окисления (–2). По химическим свойствам их подразделяют на индифферентные, или несолеобразующие (CO, NO), и солеобразующие, которые бывают основными, кислотными и амфотерными.
Химические свойства основных оксидов
1. Взаимодействуют с кислотами с образованием соли и воды, например:
MgO + 2HCl = MgCl2 + H2O.
2. Взаимодействие с кислотными оксидами с образованием солей:
CaO + CO2 = CaCO3.
3. Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием растворимых в воде оснований – щелочей:
K2O + H2O = 2KOH.
Химические свойства кислотных оксидов
1. Общим свойством всех кислотных оксидов является их способность взаимодействовать с основаниями с образованием соли и воды:
СО2 + 2NaOH = Na2CO3 + Н2О.
2. Кислотные оксиды взаимодействуют с основными оксидами с образованием солей.
3. Большинство кислотных оксидов взаимодействует с водой с образованием кислот:
SО3 + Н2О = H2SO4.
Очень немногие кислотные оксиды не взаимодействуют с водой. Наиболее известный из них оксид кремния (SiO2).
Химические свойства амфотерных оксидов
1. Амфотерные оксиды взаимодействуют с кислотами с образованием солей и воды.
ZnO + 2HNO3 = Zn(NO3)2 + 2Н2О.
В этих реакциях амфотерные оксиды играют роль основных.
2. Амфотерные оксиды взаимодействуют с щелочами с образованием солей и воды.
ZnO + 2КОН  K2ZnO2 + Н2О,
K2ZnO2 + Н2О,
ZnO + 2КОН + H2O 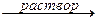 K2[Zn(OH)4].
K2[Zn(OH)4].
В этих реакциях амфотерные оксиды играют роль кислотных.
3. Амфотерные оксиды при нагревании взаимодействуют с кислотными оксидами с образованием солей:
ZnO + CO2 = ZnCO3.
4. Амфотерные оксиды при нагревании взаимодействуют с основными оксидами с образованием солей:
ZnO + Na2O = Na2ZnO2.
Получение оксидов
Оксиды могут быть получены различными способами:
1. Взаимодействием простых веществ с кислородом:
2Mg + О2 = 2MgO;
2. Разложением некоторых оксокислот:
H2SO3 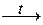 = SO2 + Н2О.
= SO2 + Н2О.
3. Разложением нерастворимых оснований:
Сu(OH)2 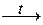 CuO+ H2O.
CuO+ H2O.
4. Разложением некоторых солей:
СаСО3 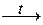 СаО + СО2.
СаО + СО2.
Основания ‑сложные вещества, при диссоциации которых в воде образуются гидроксид-ионы и никаких других анионов.
По растворимости в воде основания делятся на две группы: нерастворимые [Fe(OH)3, Си(ОН)2 и др.] и растворимые в воде [КОН, NaOH, Са(ОН)2, Ва(ОН)2 ], или щелочи.
Химические свойства оснований
Общие свойства оснований объясняются наличием в растворах анионов ОН-, которые образуются в результате электролитической диссоциации молекул оснований:
NaOH  Na+ + OH-.
Na+ + OH-.
1. Водные растворы щелочей изменяют окраску индикаторов.
Таблица 6 ‑ Изменение цвета индикаторов в растворах
щелочей и кислот
| Индикатор | Цвет индикатора | Цвет индикатора в растворе щелочи (рН > 7) | Цвет индикатора в растворе кислоты (рН < 7) |
| Лакмус | Фиолетовый | Синий | Красный |
| Фенолфталеин | Бесцветный | Малиновый | Бесцветный |
| Метилоранж | Оранжевый | Желтый | Красный |
2. Основания взаимодействуют с кислотами с образованием соли и воды (реакция нейтрализации). Например:
КОН + НС1= КС1 + Н2О;
Fe(OH)2 +2HNO3 = Fe(NO3)2 + 2Н2О.
3. Щелочи взаимодействуют с кислотными оксидами с образованием соли и воды:
Са(ОН)2 + СО2 = СаСО2 + Н2О.
4. Растворы щелочей взаимодействуют с растворами солей, если в результате образуется нерастворимое основание или нерастворимая соль. Например:
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4;
Ва(ОН)2 + Na2SO4 = 2NaOH + BaSO4↓.
5. Нерастворимые основания при нагревании разлагаются на основный оксид и воду.
2Fе(ОН)3  Fе2О3 + ЗН2О.
Fе2О3 + ЗН2О.
6. Растворы щелочей взаимодействуют с металлами, которые образуют амфотерные оксиды и гидроксиды (Zn, Al и др.).
2AI + 2КОН + 6Н2О = 2K[A1(OH)4] + 3H2↑.
Получение оснований
1. Получение растворимых оснований:
а) взаимодействием щелочных и щелочноземельных металлов с водой:
2Na + 2Н2О = 2NaOH + Н2↑;
б) взаимодействием оксидов щелочных и щелочноземельных металлов с
водой:
Na2O + Н2О = 2NaOH.
2. Получение нерастворимых оснований действием щелочей на растворимые соли металлов:
2NaOH + FeSO4 = Fe(OH)2↓ + Na2SO4.
Кислоты ‑ сложные вещества, при диссоциации которых в воде, образуются ионы водорода (гидроксония) и никаких других катионов.
Химические свойства
Общие свойства кислот в водных растворах обусловлены присутствием ионов Н+ (вернее H3O+), которые образуются в результате электролитической диссоциации молекул кислот:
1. Кислоты одинаково изменяют цвет индикаторов (табл. 7).
2. Кислоты взаимодействуют с основаниями. Например:
Н3РО4 + 3NaOH=Na3PO4+ЗН2О;
Н3РО4 + 2NaOH = Na2HPO4 + 2Н2О;
Н3РО4 + NaOH = NaH2PO4 + Н2О;
2НС1 + Сu(ОН)2 = СuС12 + 2Н2О;
НС1 + Сu(ОН)2 = СuОНСl + Н2О.
3. Кислоты взаимодействуют с основными оксидам:
2НСl + СаО = СаС12 + Н2О;
H2SO4 +Fe2O3=Fe2(SO4)3+ ЗН2О.
4. Кислоты взаимодействуют с амфотерными оксидами:
2HNO3 + ZnO = Zn(NO3)2 + Н2О.
5. Кислоты взаимодействуют с некоторыми средними солями с образованием новой соли и новой кислоты, реакции возможны в том случае, если в результате образуется нерастворимая соль или более слабая (или более летучая) кислота, чем исходная. Например:
2НС1+Na2CO3=2NaCl+H2CO3;
NaCl + H2SO4 = HCl + Na2SO4.
6. Кислоты взаимодействуют с металлами. Характер продуктов этих реакций зависит от природы и концентрации кислоты и от активности металла. Например, разбавленная серная кислота, хлороводородная кислота и другие кислоты‑неокислители взаимодействуют с металлами, которые находятся в электрохимическом ряду напряжения левее водорода. В результате реакции образуются соль и газообразный водород:
H2SO4 (разб)) + Zn = ZnSO4 + Н2↑;
НС1 + Mg = MgО + H2↑.
Кислоты-окислители (концентрированная серная кислота, азотная кислота HNO3 любой концентрации) взаимодействуют и с металлами, стоящими в ряду напряжения после водорода с образованием соли и продукта восстановления кислоты. Например:
2H2SO4 (конц) + Zn = ZnSO4 +SO2↑+ 2H2O;
Получение кислот
1. Бескислородные кислоты получают путем синтеза из простых веществ и последующим растворением продукта в воде.
S + Н2 = Н2S.
2. Оксокислоты получают взаимодействием кислотных оксидов с водой.
SO3 + Н2О = H2SО4.
3. Большинство кислот можно получить взаимодействием солей с кислотами.
Na2SiО3 + H2SO4 = H2SiО3 + Na2SO4.
 2015-06-26
2015-06-26 14336
14336
