Рассматривая экспериментальные изотермы реального газа, мы впервые обнаружили, что вещество при одинаковых внешних условиях может находиться в различных состояниях: жидком и парообразном, или, как говорят, в разных агрегатных состояниях или фазах. Вообще фазами (агрегатными состояниями вещества) называют такие состояния вещества, которые могут сосуществовать друг с другом, соприкасаясь между собой, и быть отделенными друг от друга четко выраженной границей. Если две или несколько фаз вещества соприкасаются друг с другом, то между ними возможен как обмен энергией в форме теплоты или работы, так и обмен частицами (массой). Если число частиц одной из фаз не увеличивается за счет другой фазы, то говорят, что фазы находятся в равновесии друг с другом. Переход вещества из одной фазы в другую называется фазовым переходом, или фазовым превращением. Такими переходами являются переход вещества из жидкого состояния в газообразное и обратный переход из газообразного состояния в жидкое. Первый переход называют испарением (или парообразованием), а второй – конденсацией. Эти переходы происходят при постоянной температуре и давлении и изображаются горизонтальным участком ae экспериментальной изотермы. При сжатии газа вдоль отрезка ae происходит конденсация, а при растяжении жидкости вдоль отрезка ea – парообразование.
|
|
|
Испарение – непрерывный процесс вылета молекул с поверхности жидкости, обусловленный их тепловым движением. Для вылета с поверхности испаряющаяся молекула должна преодолеть силы притяжения со стороны оставшихся молекул, т.е. совершить работу 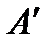 против этих сил. Кроме того, испаряющаяся молекула должна еще совершить работу
против этих сил. Кроме того, испаряющаяся молекула должна еще совершить работу 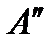 против внешнего давления, связанную с увеличением объема вещества при переходе из жидкого состояния в пар. Очевидно, что обе эти работы могут быть совершены только за счет кинетической энергии теплового движения молекул жидкости. В жидкостях, как и в газах, средняя скорость теплового движения молекул при данной температуре постоянна. Однако всегда отдельные молекулы имеют скорости и больше и меньше средней. Только наиболее быстрые молекулы жидкости обладают кинетической энергией, достаточной для совершения работы, связанной с переходом в пар. Поэтому при испарении жидкость покидают наиболее высокоэнергичные молекулы, и вследствие этого средняя энергия молекул, оставшихся в жидкости, уменьшается, т.е. жидкость охлаждается. Чтобы при испарении температура жидкости не понижалась, жидкость необходимо непрерывно нагревать. Количество теплоты, которое нужно сообщить одному молю жидкости, имеющей температуру Т, чтобы превратить ее в пар при той же температуре, называют молярной теплотой испарения. Так как процесс перехода является изобаро-изотермическим, то эта теплота равна сумме указанных выше работ:
против внешнего давления, связанную с увеличением объема вещества при переходе из жидкого состояния в пар. Очевидно, что обе эти работы могут быть совершены только за счет кинетической энергии теплового движения молекул жидкости. В жидкостях, как и в газах, средняя скорость теплового движения молекул при данной температуре постоянна. Однако всегда отдельные молекулы имеют скорости и больше и меньше средней. Только наиболее быстрые молекулы жидкости обладают кинетической энергией, достаточной для совершения работы, связанной с переходом в пар. Поэтому при испарении жидкость покидают наиболее высокоэнергичные молекулы, и вследствие этого средняя энергия молекул, оставшихся в жидкости, уменьшается, т.е. жидкость охлаждается. Чтобы при испарении температура жидкости не понижалась, жидкость необходимо непрерывно нагревать. Количество теплоты, которое нужно сообщить одному молю жидкости, имеющей температуру Т, чтобы превратить ее в пар при той же температуре, называют молярной теплотой испарения. Так как процесс перехода является изобаро-изотермическим, то эта теплота равна сумме указанных выше работ:
|
|
|
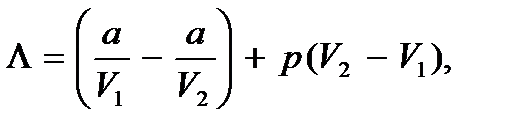
где первый член равен 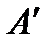 и представляет собой изменение внутренней энергии одного моля жидкости при превращении ее в пар. Оно связано с разрывами межмолекулярных сил при испарении и поэтому равно изменению потенциальной энергии молекул, содержащихся в одном моле вещества при переходе его из жидкой фазы в газообразную; определено с использованием модели реального газа Ван-дер-Ваальса. Второй член равен
и представляет собой изменение внутренней энергии одного моля жидкости при превращении ее в пар. Оно связано с разрывами межмолекулярных сил при испарении и поэтому равно изменению потенциальной энергии молекул, содержащихся в одном моле вещества при переходе его из жидкой фазы в газообразную; определено с использованием модели реального газа Ван-дер-Ваальса. Второй член равен 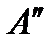 , и представляет собой отнесенную к одному молю работу, совершаемую веществом при расширении;
, и представляет собой отнесенную к одному молю работу, совершаемую веществом при расширении; 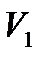 и
и 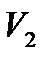 – молярные объемы соответственно жидкости и пара, p – давление перехода. При обратном процессе перехода из пара в жидкость (при конденсации) теплота, затраченная на испарение, отдается обратно и образующаяся в результате конденсации жидкость нагревается. Это – частные случаи общего правила, согласно которому фазовый переход, происходящий при нагревании, всегда сопровождается поглощением тепла, а при охлаждении – выделением тепла. В свою очередь, это правило является следствием принципа Ле-Шателье: нагревание стимулирует процессы, сопровождающиеся поглощением тепла и тем самым как бы противодействующие внешнему воздействию. С повышением температуры жидкости молярная теплота парообразования уменьшается и в критической точке, т.е. при температуре, при которой исчезает различие между жидкостью и паром, обращается в нуль.
– молярные объемы соответственно жидкости и пара, p – давление перехода. При обратном процессе перехода из пара в жидкость (при конденсации) теплота, затраченная на испарение, отдается обратно и образующаяся в результате конденсации жидкость нагревается. Это – частные случаи общего правила, согласно которому фазовый переход, происходящий при нагревании, всегда сопровождается поглощением тепла, а при охлаждении – выделением тепла. В свою очередь, это правило является следствием принципа Ле-Шателье: нагревание стимулирует процессы, сопровождающиеся поглощением тепла и тем самым как бы противодействующие внешнему воздействию. С повышением температуры жидкости молярная теплота парообразования уменьшается и в критической точке, т.е. при температуре, при которой исчезает различие между жидкостью и паром, обращается в нуль.
В закрытом сосуде при постоянной температуре процессы испарения и конденсации идут одновременно. Если преобладает первый из них, то количество жидкости уменьшается, а количество пара над ней увеличивается. Если же преобладает второй процесс, то количество пара уменьшается, а количество жидкости растет. Когда число N исп молекул, покидающих жидкость за единицу времени, равно числу N конд молекул, возвращающихся в нее за то же время из пара, то имеет место динамическое (подвижное) равновесие, при котором количество жидкости и пара над ней не изменяется (N исп = N конд), а пар в этом случае является насыщенным.
При нагревании жидкости до температуры, при которой упругость (давление) ее насыщенного пара становится равной внешнему давлению, испарение жидкости происходит не только с ее поверхности, но и там, где возникают пузырьки пара. Такой процесс испарения называется кипением. Кипение происходит лишь при условии, что в жидкости уже имеются пузырьки растворенного газа (чаще всего воздуха). Эти пузырьки располагаются обычно на стенках сосуда и служат резервуаром, куда может испаряться жидкость. Но пока давление насыщенного пара меньше атмосферного, эти пузырьки остаются почти неизменными. Когда же с ростом температуры давление насыщенного пара сравняется с внешним давлением, пузырьки начинают расти. Под действием архимедовой силы они всплывают на поверхность и, лопаясь, выбрасывают пар в окружающее пространство, обеспечивая дополнительный выход пара. Начинается кипение жидкости. Таким образом, кипение происходит при такой температуре, при которой давление насыщенного пара жидкости равно внешнему давлению. Эта температура называется температурой кипения. При повышении внешнего давления температура кипения возрастает.
Обычно при отрыве от стенки пузырек оставляет на своем месте маленький зародыш, который снова расширяется, и т.д. В этом и состоит сущность процесса кипения. Кипение протекает бурно, практически вся подводимая теплота идет на испарение, и температура жидкости остается неизменной во все время кипения.
 2015-09-06
2015-09-06 2610
2610
