| Прокариотическая рибосома | Эукариотическая рибосома | ||
| 70S | 80S | ||
| 50S | 30S | 60S | 40S |
| 5S rРНК 23S rРНК | 16S rРНК | 5S rРНК 5.8S rРНК 28S rРНК | 18S rРНК |
| 34 молекулы белков, из них 31 разные | 21 белок | не менее 50 разных белков | не менее 33 разных белков |
rРНК выполняют не только функцию каркасов субъединиц рибосом, но и принимают непосредственное участие в синтезе полипептидов.
23S rРНК входит в каталитический пептидилтрансферазный центр, 16S rРНК необходима для установки на 30S субъединице инициирующего кодона mРНК, 5S rРНК - для правильной ориентации аминоацил-tРНК на рибосоме.
Все rРНК обладают развитой вторичной структурой: около 70% нуклеотидов собрано в шпильки.
rРНК в значительной степени метилированы (СН3-группа во втором положении рибозы, а также в азотистых основаниях).
Порядок сборки субъединиц из rРНК и белков строго определен. Субъединицы, не соединенные друг с другом, представляют собой диссоциированные рибосомы. Соединенные - ассоциированные рибосомы. Для ассоциации нужны не только конформационные изменения, но и ионы магния Mg2+ (до 2х103 ионов на рибосому). Магний нужен для компенсации отрицательного заряда rРНК. Все реакции матричного синтеза (репликация, транскрипция и трансляция) связаны с ионами магния Mg2+ (в меньшей степени - марганца Mn2+).
|
|
|
Каталитические центры рибосом
| Асп - центр специфического узнавания. Здесь происходит взаимодействие кодон-антикодон. Р-центр - пептидильный, донорный. Он является донором формилметионина при инициации, или пептидила при элонгации трансляции. А-центр - аминоацильный, акцепторный. Акцептирует формилметионин в самом начале или пептидил при элонгации трансляции. К-центр - каталитический (фермент пептидилтрансфераза). В К-центре задействована 23S rРНК и несколько белков большой субъединицы. |
Синтез полипептидов на рибосоме
У прокариот перед каждым геном и соответственно в mРНК перед копией каждого гена имеется лидерная последовательность.
| Она может быть разного размера (до 160 нукл.) и разной первичной структуры, но обязательно содержит полипуриновую последовательность Шайна-Дальгарно, которая комплементарна 3'-концевому участку 16S rРНК. Комплементарными могут быть 3-9 нуклеотидов. | 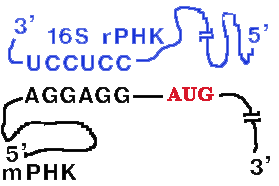
|
Назначение комплементарного взаимодействия 3'-концевого участка 16S rРНК и последовательности Шайна-Дальгарно - правильная установка инициирующего кодона AUG на малой субъединице рибосомы.
Инициирующий кодон находится на растоянии 3-10 нукл. от последовательности Шайна-Дальгарно.
| К малой субъединице, на которой уже находится mРНК, подходит формилметиониновая tРНК, соединенная с формилметионином. В результате образуется инициаторный комплекс: 30S субъединица рибосомы + mРНК + формилметионовая tРНК-формилметионин. Затем происходит ассоциация рибосомы. При этом изменяется конформация 16S rРНК и нарушается связь между ней и последовательностью Шайна-Дальгарно. | 
|
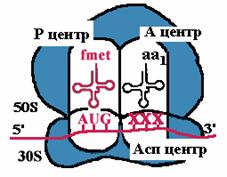
| Аминоацильный конец формилметиониновой tРНК оказывается в Р-центре. Второй кодон гена оказывается в Асп-центре. Соответствующая ему аминоацил-tРНК устанавливается таким образом, что ее аминоацильный конец попадает в А-центр. |
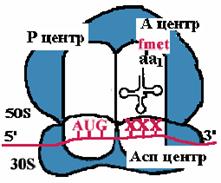
| Пептидилтрансфераза отрывает формилметионин в Р-центре и переносит его в А-центр. Образуется пептидная связь между формилметионином и аминоацил-tРНК. |
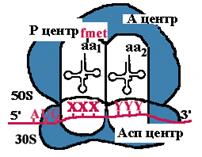
| Рибосома претерпевает конформационные изменения и сдвигается на один кодон. Формилметиониновая tРНК покидает рибосому. Второй кодон оказывается напротив Р-центра. Сюда же переходит tРНК, несущая на хвосте дипептид. В Асп-центр попадает третий кодон, а в А-центр очередная аминоацил-tРНК. |
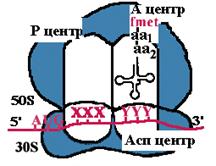
| Теперь в Р-центре отрывается дипептид, переносится в А-центр и соединяется с третьей аминоацил-tРНК. Так продолжается до тех пор, пока в Асп-центр не приходит терминирующий кодон. Полипептид отрывается в Р-центре, переносится в А-центр и, т.к. присоединиться ему не к чему, он отваливается от рибосомы. Рибосома диссоциирует и малая субъединица сканирует mРНК. |
In vivo на каждой стадии (образования инициаторного комплекса, инициации, элонгации и терминации) участвуют различные белковые факторы, которые препятствуют посадке на рибосому деацилированных tРНК или запрещают посадку формилметиониновой-tРНК в А-центр.
|
|
|
На всех этапах принимают участие молекулы ГТФ, которые дефосфорилируются.
Смысл гидролиза ГТФ не в отдаче энергии, а в свидетельстве того, что данный этап трансляции пройден.
| Все синтезируемые полипептиды прокариот на N-конце несут формилметионин. В 20% случаев он отщепляется, а в 80% отщепляется только формильная группа и на N конце остается метионин. | 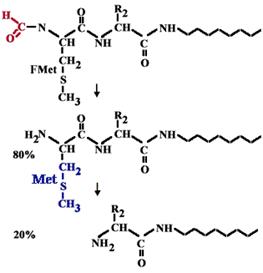
|
18. 1. Около 1% в геноме человека занимают встроенные гены ретровирусов (эндогенные ретровирусы). Эти гены обычно не приносят пользы хозяину, но существуют и исключения. Так, около 43 млн. лет назад в геном предков обезьян и человека попали ретровирусные гены, служившие для построения оболочки вируса. У человека и обезьян эти гены участвуют в работе плаценты.
Большинство ретровирусов встроились в геном предков человека свыше 25 млн. лет назад. Среди более молодых человеческих эндогенных ретровирусов полезных на настоящий момент не обнаружено.
2. 1) Регуляция на стадии инициации трансляции (Инициация трансляции как ключевой этап осуществления регуляции трансляции в целом). Механизмы регуляции на стадии трансляции менее экономичны, зато отличаются быстротой реагирования на изменения потребности клетки в данном белке. Регуляторные механизмы трансляции направлены на то, чтобы: а) разрешить или не разрешить синтез белка по мРНК. Специальные механизмы “не разрешают” всем или только некоторым уже построенным мРНК являться матрицами при синтезе белковых молекул. Такие мРНК в неактивной форме могут храниться “про запас”. б) если синтез разрешен, задать скорость (эффективность) построения белковой молекулы. Скорость синтеза белка данного вида можно изменить, изменив число рибосом, прощедших по данной мРНК: чем больше рибосом – тем больше молекул белка будет синтезировано. Как при транскрипции, в большинстве случаев регуляция трансляции идет через регуляцию ее инициации. Для этого существуют 3 основных способа: 1. Дискриминация мРНК (уметь отличать, распознавать; имеется как у про -, так и у эукариот). Рибосомы либо сами (у прокариот), либо с помощью белковых факторов инициации (у эукариот) “распознают”, с каких мРНК им строить много копий белка, а с каких – мало. Это способ позитивной регуляции на основе сродства мРНК к рибосомам и факторам инициации трансляции.
|
|
|
2. Трансляционная репрессия (как у про -, так и у эукариот) и маскирование мРНК (только у эукариот) – негативная регуляция либо с помощью белков (в первом случае белок-репрессор связывается с определенным участком на мРНК, тем самым, мешая присоединению к мРНК рибосомы. Вещество-эффектор, появляясь в среде, снимает белок-репрессор с мРНК и разблокирует синтез белка), либо с помощью особых микроРНК, находящихся в составе белковых комплексов (во втором случае присоединение к мРНК антисмысловой микроРНК также вызывает трансляционную репрессию, причины которой в настоящее время продолжают изучаться). Способами 1 и 2 трансляция каждой мРНК может контролироваться независимо от других мРНК.
Трансляционная репрессия В зависимости от внешних сигналов (эффекторов), либо по типу обратной связи. Трансляционная репрессия используется для тонкой регуляции белкового синтеза как у про-, так и у эукариот. Трансляционная репрессия может вызываться:
– специальными белками-репрессорами (рис. 21),
– особыми комплексами, в состав которых входят микроРНК –комплексы miRISC.
Трансляционная репрессия с помощью белков заключается в том, что белок-репрессор, связываясь с рибосомсвязывающим участком на 5’-конце мРНК, мешает рибосомной убъединице присоединиться к мРНК. Репрессором может быть:
1) сам синтезируемый по данной мРНК белок. Например, если в бактериальной клетке возникает избыток фермента треонил-тРНК-систетазы, этот фермент становится репрессором, блокируя свой собственный синтез. 2) специальный белок, на данной мРНК не закодированный. Способность такого белка связываться с определенными мРНК зависит от присутствия того
или иного низкомолекулярного компонента – эффектора. Например, у животных синтез железозапасающего белка ферритина заблокирован белком- репрессором IRP и разблокируется лишь после взаимодействия репрессора с эффектором – ионами железа. (есть железо – заблокирован, нет-разблокирован)
|
|
|
Маскирование мРНК у эукариот При маскировании маскирующие белки-репрессоры присоединяются не к 5’-концевым областям мРНК (как в случае трансляционной репрессии), а к ее 3’-концевым областям. Присоединение белка делает мРНК недоступной не только для инициации трансляции, но и для других процессов ее изменения. Маскирование обеспечивает эукариотам возможность накопить мРНК “впрок”.
3. Тотальная регуляция трансляции всей совокупности мРНК клетки (только у эукариот). Она осуществляется через изменение активности факторов инициации трансляции (обычно – через инактивацию фактора eIF2).
Дискриминация мРНК (регуляция количеством рибосом). мРНК могут отличаться по скорости и частоте “нанизывания” на них рибосом. Одни мРНК – сильные – легко связываются с рибосомой. На другие мРНК – слабые – рибосомы нанизываются значительно хуже, поэтому и продукция белка невысока. Структурные белки мембран, рибосомные белки, факторы элонгации, белки оболочки вирусов и другие белки, требующиеся в больших количествах кодируются сильными мРНК, а многие специализированные ферменты и регуляторные белки – слабыми мРНК. Сильной или слабой окажется мРНК – зависит от строения ее 5’- концевых инициирующих и рибосомсвязывающих участков. У прокариот дискриминация идет из-за разного сродства рибосом к этим участкам, а у эукариот – из-за разного сродства к этим же участкам белков – факторов инициации трансляции.
 2015-09-06
2015-09-06 2786
2786