Кэп
5' кэп (или кап) (от англ. cap — шапочка) — это модифицированный гуанидиновый нуклеотид, который добавляется на 5' (передний) конец незрелой мРНК. Эта модификация очень важна для узнавания мРНК при инициации трансляции, а также для защиты от 5’нуклеаз — ферментов, разрушающих цепи нуклеиновых кислот с незащищённым 5'-концом.
Кодирующие области
Кодирующие области состоят из кодонов — следующих непосредственно друг за другом последовательностей из трёх нуклеотидов, каждая из которых соответствует в генетическом коде определённой аминокислоте или началу и концу синтеза белка. Кодирующие области начинаются со старт-кодона и заканчиваются одним из трёх стоп-кодонов. Считывание последовательности кодонов и сборка на её основе последовательности аминокислот синтезируемой молекулы белка осуществляется рибосомами при участии транспортных РНК в процессе трансляции. В дополнение к кодированию белков, части кодирующих областей могут служить управляющими последовательностями. Например, вторичная структура РНК в некоторых случаях определяет результат трансляции.
|
|
|
Моноцистронная и полицистронная мРНК
мРНК называют моноцистронной, если она содержит информацию, необходимую для трансляции только одного белка (один цистрон). Полицистронная мРНК кодирует несколько белков. Гены (цистроны) в такой мРНК разделены интергенными, некодирующими последовательностями. Полицистронные мРНК характерны для прокариот и вирусов, у эукариот большая часть мРНК является моноцистронной [4]. Полицистронные мРНК встречаются у эукариот в митохондриях.
Нетранслируемые области
Нетранслируемые области — участки РНК, расположенные до старт-кодона и после стоп-кодона, которые не кодируют белок. Они называются 5'-нетранслируемая область и 3'-нетранслируемая область, соответственно. Эти области транскрибируются в составе того же самого транскрипта, что и кодирующий участок. Нетранслируемые области имеют несколько функций в жизненном цикле мРНК, включая регуляцию стабильности мРНК, локализации мРНК и эффективности трансляции. Стабильность мРНК может контролироваться 5'- и/или 3'-областью из-за различной чувствительности к ферментам, которые отвечают за деградацию РНК — РНКазам и регуляторным белкам, которые убыстряют или замедляют деградацию[5].
полиадениновый хвост
Длинная (часто несколько сотен нуклеотидов) последовательность адениновых оснований, которая присутствует на 3' «хвосте» мРНК эукариот, синтезируется ферментом полиаденилат-полимеразой. У высших эукариот поли-А-хвост добавляется к транскрибированной РНК, которая содержит специфическую последовательность, AAUAAA. Важность этой последовательности можно увидеть на примере мутации в гене человеческого 2-глобина, которая изменяет AAUAAA на AAUAAG, что приводит к недостаточному количеству глобина в организме[6].
|
|
|
Вторичная структура
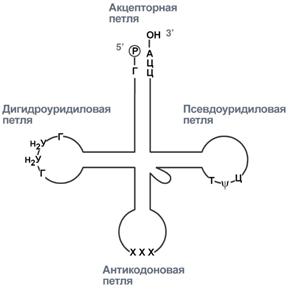
внешний вид вторичной структуры тРНК после процессинга
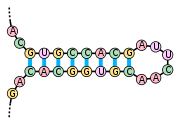
«Стебель-петля» — элемент вторичной структуры мРНК, схематично

«Псевдоузел» — элемент вторичной структуры мРНК, схематично
Кроме первичной структуры (последовательности нуклеотидов), мРНК обладает вторичной структурой. В отличие от ДНК, вторичная структура которой основана на межмолекулярных взаимодействиях (двойная спираль ДНК образована двумя линейными молекулами, соединенными друг с другом по всей длине водородными связями), вторичная структура мРНК основана на внутримолекулярных взаимодействиях (линейная молекула «складывается», и водородные связи возникают между разными участками одной и той же молекулы).
Примерами вторичной структуры могут служить стебель-петля и псевдоузел [7]
Вторичные структуры в мРНК служат для регуляции трансляции. Например, вставка в белки необычных аминокислот, селенометионина и пирролизина, зависит от стебля-петли, расположенной в 3' нетранслируемой области. Псевдоузлы служат для программированного изменения рамки считывания генов.
В вирусных мРНК сложные вторичные структуры (Инициация трансляции»).
2. Строение иРнк(19 вопрос). Адапторная функция тРнк. Взаимодействие кодон-антикодон. Строение и роль рибосом в синтезе белка.
Адапторная роль тРнк.
тРнк является единственным посредником между 4-х буквенной последовательностью нуклеиновых кислот и 20-ти буквенной последовательностью белков. Каждая тРнк имеет определенную триплетную последовательность в антикодоновой петле (антикодон) и может присоединить только такую АК, которая соответствует этому антикодону. Именно от наличия того или иного антикодона в тРнк зависит, какая АК включится в белковую молекулу, т.к. ни рибосома, ни мРНК не узнают аминокислоту. Таким образом, адапторная роль тРНК заключается:
1) в специфичном связывании с аминокислотами,
2) в специфичном, согласно кодон-антикодоновому взаимодействию, связывании мРНК,
3) во включении аминокислот в белковую цепь в соответствии с информацией мРНК.
Присоединение АК к тРНК осуществляется ферментом аминоацил-тРНК-сентетазой, имеющей специфичность одновременно к двум соединениям: какой-либо АК-те и соответствующей ей тРНК. Для реакции требуется две макроэргические связи АТФ. АК присоединяется к 3’-
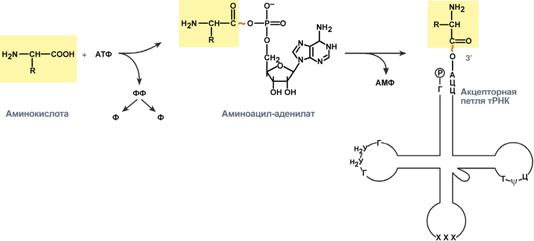
Реакция синтеза аминоацил-тРНК
Т.к. существует около 60 различных тРНК, то некоторым аминокислотам соответствует по две или более тРНК. Различные тРНК, присоединяющие одну аминокислоту, называют изоакцепторными.
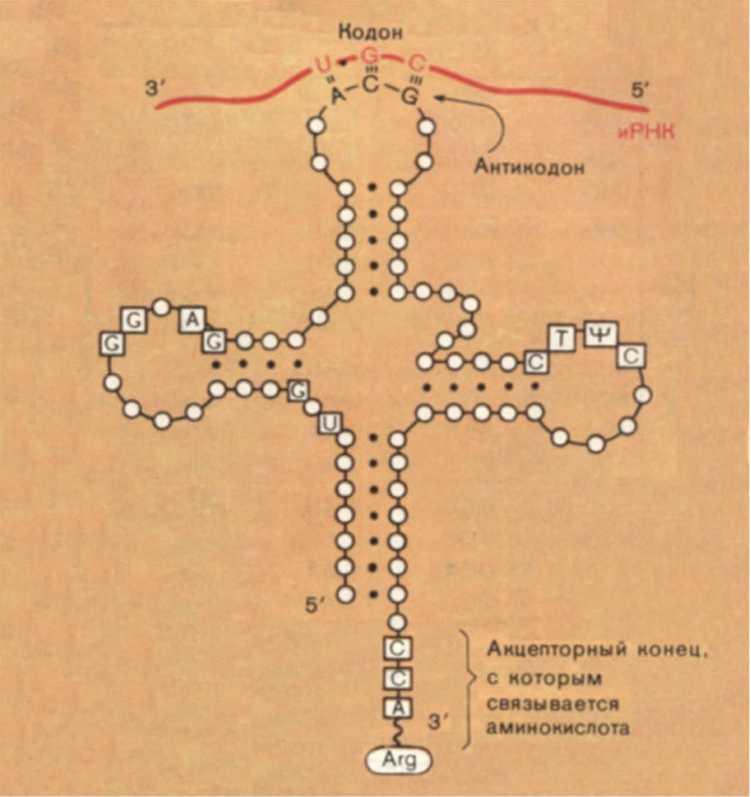
Взаимодействие кодон-антикодон.
Кодон-антикодоновое взаимодействие – это способ узнавания триплетом (которым является м-РНК) комплементарного триплета (им является антикодон), входящего в состав соответствующей т-РНК.
Кодон и антикодон спариваются антипараллельным образом (теорий качаний Крика):
1. Два первых основания кодонов образуют прочные пары с соответствующими азотистыми основаниями антикодона.
2. Находящиеся в третьем положении азотистые основания кодонов образуют слабые водородные связи с антикодоном.
3. Вывод Крика: находящиеся в третьем положении основания большинства кодонов имеют некоторую степень свободы при образовании пары с соответствующими азотистым основанием антикодона – это и есть качающиеся основания.
4. Именно такое взаимодействие кодона с антикодоном обеспечивает включение аминокислоты в соответствующие участки полипептидной цепи синтезирующегося белка.
|
|
|


 2015-10-16
2015-10-16 6758
6758






