Наиболее широкое применение получили неорганические и органические соединения меди (МП — медьсодержащие пестициды). Из МП широко применяют медный купорос, бордосскую жидкость, хлорокись меди.
МП сильно раздражают слизистые оболочки желудочно-кишечного тракта и верхних дыхательных путей. ЛД для взрослого человека составляет 10 г, а тяжелые отравления наблюдаются при дозах менее 2 г. Кроме того, МП могут оказывать местное раздражающее действие на кожу (экзема, дерматиты).
Из органических металлсодержащих пестицидов в некоторых странах применяются оловоорганические пестициды (ООП) в качестве акарицидов, бактерицидов и антисептиков. ООП высокотоксичны для теплокровных животных и человека. Симптомы отравления аналогичны симптомам при отравлении оловом.
По данным ООН, из общего числа отравлений химическими средствами со смертельным исходом в мире на долю пестицидов приходится 2,6 %. Согласно той же статистике, обезболивающие лекарства стали причиной смертельных отравлений в 17,4 % случаев, алкоголь - в 10,5 % случаев.
|
|
|
Таким образом, пестициды нельзя отнести к химическим средствам, представляющим реальную угрозу в повседневной жизни человека. Однако существует опасность косвенного (через пищевые цепи) влияния пестицидов на здоровье человека и его наследственный аппарат. Следовательно, токси-колого-гигиенические проблемы, возникающие при применении пестицидов, носят хронический характер.
Попавшие в организм посторонние вещества становятся физиологически активными в том случае, когда они соединяются с рецепторами. В качестве рецепторов могут служить белки клеточных мембран, ферменты и другие белки (актин, миозин), способные встраиваться в биологические процессы. Механизм расщепления пестицидов во многих случаях не установлен. Основные данные относятся к накоплению пестицидов в жировых клетках и материнском молоке.
Инсектициды на основе ХОП проникают в организм человека через пищеварительный тракт и кожу. Располагаясь в мембранах нервных клеток, они изменяют способность к возбудимости.
Алкилфосфаты являются сильными ингибиторами ацетилхолинэстеразы. Снижение активности этого фермента приводит к накоплению ацетилхолина, что вызывает отек легких, тошноту, понос, ухудшение зрения, повышение артериального давления, мышечные спазмы, судороги.
2,4-дихлорфеноксиуксусная кислота (2,4-Д) и 2,4,5-трихлорфеноксиуксусная кислота (2,4,5-Т) обладают исключительной устойчивостью, поэтому систематический контроль за их содержанием в пищевой продукции обязателен.
В настоящее время споры о применении или же полном запрете пестицидов продолжаются. Ученые разных областей науки (химики, аграрии, медики) — каждый со своих позиций, приводят убедительные доводы как за, так и против. Очевидно, что лишь общие усилия помогут найти правильное решение этой сложнейшей проблемы.
|
|
|
Мониторинг, проводимый в США на содержание пестицидов в пищевых продуктах, показывает, что 80...90 % их не содержит пестицидов совсем, 10% содержит допустимые нормы и только 0,7 %- выше нормы. Интересно отметить, что в странах наиболее интенсивного применения пестицидов самая высокая продолжительность жизни людей, что не является признаком положительного действия применения пестицидов на продолжительность жизни, а характеризует лишь отсутствие их достаточно заметного отрицательного влияния при правильном применении. Во всем мире ведется интенсивная работа по совершенствованию ассортимента применяемых пестицидов и уменьшения их вредного воздействия на окружающую среду. В настоящее время на эти работы фирмами - производителями пестицидов, а также из федеральных бюджетов экономически развитых стран, таких, как США, Англия, Франция, Япония, Германия, Швейцария, расходуется более 2 млрд долл. в год.
На эффективность снижения остаточных количеств (ОК) пестицидов влияет характер их распределения в разных частях растений.
Основное количество ХОП и ФОП концентрируются в кожуре плодов и овощей или на ее поверхности, почти не проникая внутрь. Поэтому начальным этапом промышленной и кулинарной обработки фруктов, овощей и ягод является их мытье. Оно может осуществляться водой, раствором щелочей, ПАВ. Например, хорошо смываются водой ООП.
Но мытье малоэффективно, когда пищевое сырье содержит препараты, обладающие липофильными свойствами, и прочно связанные с восками кутикулы. В этом случае следует использовать салфетки и различные моющие средства, удаляющие жиры и воски (детергенты, сода, спирты).
Более эффективный способ снижения ОК пестицидов в пищевых продуктах (на 90... 100 %) - очистка от наружных частей растений.
Освобождение продуктов питания от ОК пестицидов происходит при использовании традиционных технологий их переработки и кулинарной обработки, таких как варка, жарение, печение, консервирование, изготовление варенья, джема.
В процессе сушки в зависимости от ее характера, вида сырья и свойств препаратов может происходить или концентрирование остатков пестицидов, или их удаление и разрушение.
При переработке зерновых культур ОК пестицидов неравномерно распределяются в различных фракциях помола. Наибольшие количества обнаруживаются в отрубях, наименьшие в муке тонкого помола.
При варке мяса ОК пестицидов переходят в бульон, а некоторые пестициды могут трансформироваться в более токсичные соединения.
Скорость деструкции ОК пестицидов в хранящихся продуктах возрастает с увеличением влажности продуктов, температуры, времени хранения.
§ 2.7. Минеральные вещества
Минеральные вещества в большинстве случаев составляют 0,7–1,5% (в среднем 1%) съедобной части пищевых продуктов. Исключение составляют те продукты, в которые добавляют пищевую соль (чаще 1,5–3%). Содержание минеральных веществ в пище (как макро-, так и микроэлементов) небольшое, но их биологическая активность в организме весьма высока. Минеральные вещества не обладают энергетической ценностью, однако без них жизнь человека невозможна.
Многие элементы в виде минеральных солей, комплексных соединений и органических веществ входят в состав живой материи и являются незаменимыми нутриентами, которые должны ежедневно потребляться с пищей. Содержание минеральных веществ в основных продуктах питания приведено в таблице 2.4.
Таблица 2.4. – Минеральный состав основных продуктов питания
|
|
|
(по данным И.М.Скурихина, М.Н.Волгарева «Химический состав пищевых продуктов», 1987)
| Пищевые продукты | Макроэлементы, мг/100 г | Микроэлементы, мкг/100 г | ||||||||||
| K | Ca | Mg | Na | S | P | Cl | Fe | I | Cu | F | Zn | |
| Хлеб ржаной | 5,6 | |||||||||||
| Хлеб пшеничный | – | – | ||||||||||
| Молоко коровье | ||||||||||||
| Творог жирный | – | – | – | – | ||||||||
| Сыр российский | – | – | – | – | ||||||||
| Мясо: свинина говядина | 64,8 | 6,6 | ||||||||||
| 10,2 | 7,2 | |||||||||||
| Рыба: речной карп морская треска | ||||||||||||
| Овощи: капуста белокач. картофель морковь | ||||||||||||
| Фрукты: слива яблоко | ||||||||||||
Ежедневное поступление химических элементов с пищей должно находиться на определенном уровне и столько же химических элементов должно ежесуточно выводиться из организма, поскольку их содержание в нем находится в относительном постоянстве.
Минеральные вещества выполняют пластическую функцию в процессах жизнедеятельности человека, участвуя в обмене веществ практически любой ткани человека. Особенно велика их роль в построении костной и зубной ткани, где преобладают такие элементы, как фосфор и кальций. Минеральные вещества участвуют в важнейших обменных процессах организма: водно-солевом, кислотно-щелочном, содержатся в цитоплазме и биологических жидкостях, играют основную роль в обеспечении постоянства осмотического давления, что является необходимым условием для нормальной жизнедеятельности клеток и тканей. Минеральные вещества входят в состав сложных органических соединений (гемоглобина, гормонов, ферментов). В виде ионов минеральные вещества участвуют в передаче нервных импульсов, обеспечивают свертывание крови. Многие ферментативные процессы в организме невозможны без участия тех или иных минеральных веществ.
|
|
|
Как уже говорилось, в зависимости от количества минеральных веществ в организме человека и пищевых продуктах, минеральные вещества разделяются на две группы: макроэлементы (десятки, сотни мг/кг в продуктах питания, а в организме массовая доля превышает 0,01%; Ca, P, Mg, K, Na, Cl, S) и микроэлементы (в организме ниже 10–5%; в продуктах единицы и менее мг на 100 г продукта Fe, Zn, I, F).
Микроэлементы условно делят на две группы: абсолютно или жизненно необходимые (кобальт, железо, медь, цинк, марганец, йод, бром, фтор) и так называемые вероятно необходимые (алюминий, стронций, молибден, селен, никель, ванадий и некоторые другие).
Характерным признаком необходимого элемента является колокообразный вид кривой зависимости ответной реакции организма от дозы элемента (рис. 2.1).
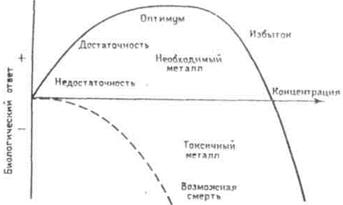
| Рис. 2.1. – Биологический ответ в зависимости от концентрации необходимого (сплошная кривая) и опасного (штриховая кривая) вещества (взаимное расположение двух кривых относительно шкалы концентрации условно) |
При малом поступлении данного элемента организму наносится существенный ущерб (сплошная кривая). Он функционирует на грани выживания. В основном это объясняется снижением активности ферментов, в состав которых входит данный элемент. Сплошная кривая указывает на немедленный положительный ответ с увеличением концентрации, начиная с нулевой отметки (предполагается, что поступающее необходимое вещество насыщает места своего связывания и не вступает ни в какие иные взаимодействия, которые на самом-то деле вполне возможны). Эта сплошная кривая описывает оптимальный уровень, охватывающий широкий интервал концентраций для многих ионов металлов. Кривая проходит через максимум и начинает падать до отрицательных величин: биологический ответ организма становится негативным, а металл переходит в разряд токсичных веществ, т.е. при дальнейшем увеличении дозы проявляется токсическое действие избытка данного элемента, в результате чего не исключается и летальный исход.
Штриховая кривая на рисунке 2.1 демонстрирует биологический ответ организма на совершенно вредное вещество, не проявляющее эффектов необходимого или стимулирующего вещества. Эта кривая идет с некоторым запаздыванием, которое свидетельствует о том, что живой организм способен «мириться» с небольшими количествами токсичного вещества (пороговая концентрация) до тех пор, пока не станет преобладать его токсическое действие. На рисунке 2.1 представлена, конечно, некая обобщающая картина; каждое вещество имеет свою собственную специфическую кривую в координатах биологический ответ – концентрация.
Из рисунка 2.1 следует также, что необходимые вещества могут стать даже токсичными при избытке их потребления. Почти любое вещество в избытке неизбежно становится опасным (даже если это действие непрямое), например, по причине ограничения усвояемости других необходимых веществ.
К наиболее дефицитным минеральным веществам в питании современного человека относятся кальций и железо, к избыточным – натрий и фосфор.
Биологическая активность и токсичность s-элементов. Среди s -элементов наиболее важные биохимические функции выполняют катионы металлов 3-го и 4-го периодов. По содержанию в живых организмах, в т.ч. и в организме человека, элементы IA группы натрий и калий принадлежат к олигобиогенным элементам в отличие от лития, рубидияи цезия,которые относятся к ультрамикробиогенным элементам. Соединения щелочных металлов входят в состав тканей и жидкостей организмов человека, животных и растений. Натрий и калий относятся к жизненно необходимым элементам. Физиологическая и биохимическая роль лития, рубидия и цезия выяснена недостаточно, и они могут быть отнесены к примесным элементам.
Катионы s-элементов 3-го и 4-го периодов, а также некоторые неорганические анионы являются основными компонентами, определяющими физико-химические свойства биологических жидкостей. Электролитный состав жидкостей организма характеризуется главным образом содержанием Na, К, Mg, Ca, S, С, Р, С1 и некоторых других элементов в виде соответствующих ионов и различается для внутриклеточной и внеклеточной жидкостей.
Состав внеклеточной жидкости близок к составу морской воды в предкембрийскую эпоху, когда появились животные с замкнутой системой кровообращения. С тех пор соленость моря продолжала возрастать, тогда как состав внеклеточной жидкости остался постоянным. Основным катионом во внеклеточной жидкости является ион Na+, а из анионов преобладают Сl– и HCO3–. Внутри клеток преобладают катион К+ и анион НРО42–. Для соблюдения физико-химического закона электронейтрапьности, которому подчиняется любой живой организм в целом, некоторый недостаток неорганических анионов компенсируется анионами органических кислот (молочной, лимонной и др.) и кислых белков, несущих отрицательный заряд при физиологических значениях рН. Если вне клетки органические анионы компенсируют незначительную нехватку отрицательного заряда, то внутри клетки они должны компенсировать около 25% положительных зарядов, создаваемых неорганическими катионами. Поскольку клеточные мембраны легко проницаемы для воды, то они могут разрушаться при незначительных различиях в давлении жидкости внутри и снаружи клеточной мембраны. Поэтому осмотическое давление внутри клетки должно быть равно таковому во внеклеточной жидкости, т.е. живая клетка подчиняется закону изоосмоляльности. Повышенное содержание катионов по отношению к концентрации анионов во внеклеточных жидкостях в сравнении с внутриклеточными средами приводит к тому, что наружная поверхность мембран клеток оказывается заряжена положительно относительно ее внутренней поверхности, и это имеет огромное биологическое значение. В биологических жидкостях концентрацию осмотически активных частиц (независимо от их заряда, размера и массы) выражают в единицах осмоляльности – миллиосмомолях на 1 кг воды. Так как главные катионы и анионы внутриклеточных жидкостей многозарядные, то (при одинаковых осмоляльностях) концентрация электролитов, выраженная в миллиэквивалентах на 1 л, будет значительно выше внутри клетки, чем во внеклеточных жидкостях, где в основном содержатся однозарядные ионы.
Биологическая активность и токсичность p-элементов. Среди р -элементов в биологических системах наиболее распространены неметаллы водород, углерод, азот, кислород, фосфор, сера и хлор,важные биологические функции выполняют микроэлементы: иод, кремний, бор, селен, фтор, мышьяк и бром.
р -Металлы в большинстве случаев токсичны для организма, что объясняется тем, что, проявляя свойства мягких кислот, их ионы образуют прочные связи с кислород- и серосодержащими группами таких биолигандов, как белки (в т.ч. ферменты), нуклеиновые кислоты и т.д.
Биологическая активность и токсичность d-элементов. d -Блок Периодической системы включает 32 элемента 4–7-го больших периодов, для которых строение внешних электронных оболочек атомов можно выразить общей формулой: (п – 1) dansb,
| где | а = | 0–10, |
| b = | 1; 2. |
Для d -металлов наиболее характерно образование координационных соединений с разнообразными, в т.ч. и биогенными, лигандами, что в основном и определяет их биологическую активность. Наличие d -орбиталей, лишь частично заполненных электронами, позволяет катионам этих металлов взаимодействовать с лигандами – анионами или электродонорными молекулами. Геометрия образующихся комплексов зависит от природы иона металла-комплексообразователя. Комплекс может иметь структуру тетраэдра, плоского квадрата, тригональной бипирамиды или октаэдра. При анализе структуры, физико-химических и биохимических свойств этих комплексов особое внимание обращается на природу связи и на геометрию комплекса. В координационных соединениях ионы d -металлов способны образовывать кроме σ-связей прямые и обратные дативные π-связи. Это обусловливает высокую комплексообразующую способность и непостоянство координационных чисел d -металлов. Как правило, в биокомплексах это четные координационные числа от 4 до 8, реже 10 и 12.
Можно утверждать, что в биосистемах свободных ионов d -металлов практически нет, так как они или гидролизуются, или находятся в составе координационных соединений. Чаще всего d- элементы участвуют в биохимических реакциях в составе комплексов с лигандами – аминокислотами, пептидами, белками, гормонами, нуклеиновыми кислотами и т.д. Наиболее распространенные металлоферменты, такие, как карбоангидраза, ксантинооксидаза, цитохромы и др., представляют собой биокомплексы d -металлов. Простетические группы гемоглобина, трансферрина и других сложных белков также представляют собой хелатные комплексы d -металлов.
Жизненно необходимые металлы Zn, Cu, Fe, Mn, Со, Мо («металлы жизни») входят в состав различных металлоферментов, катализирующих кислотно-основные и окислительно-вос- становительные биохимические реакции.
Многие соединения d -элементов, особенно производные Cd, Hg, V, Ag, Ni и Zn, оказывают на живые организмы токсическое действие, механизмы которого будут рассмотрены на конкретных примерах далее.
Большинство методов определения минеральных веществ (микроэлементов) в пищевых продуктах можно разделить на три типа.
Тип I – наиболее точные и сложные, которые могут использоваться только в исследовательских лабораториях) например, нейтронно-активационный анализ);
Тип II – арбитражные, которые требуют весьма сложного оборудования, но могут быть использованы на производстве (например, ААС)
Тип III – альтернативные (для текущих анализов), которые не требуют сложного оборудования, но по точности не уступают методам II типа (колориметрические, полярографические).
Для анализа минеральных веществ в основном используются физико-химические методы – оптические и электрохимические.
Оптические методы. Фотометрический анализ. Фотометрический анализ (молекулярная абсорбционная спектроскопия) основан на поглощении молекулами вещества излучений в ультрафиолетовой, видимой и инфракрасной областях электромагнитного спектра (медь, железо, хром, никель и др.).
- Фотоэлектроколориметрия – основана на измерении поглощения окрашенными растворами монохроматического излучения в видимой области спектра. Измерение с помощью фотоэлектроколориметров, снабженных узкополосными светофильтрами.
- Спектрофотометрия – измерение поглощения монохроматического излучения в УФ, видимой и ИК областях спектра. Измерения с помощью спектрофотометров, где в качестве монохроматоров – диспергирующие призмы и дифракционные решетки.
Количественный анализ обычно проводят методом градуировочного графика.
Эмиссионный спектральный анализ. Эмиссионный спектральный анализ основан на измерении длины волны, интенсивности и других характеристик света, излучаемого атомами и ионами вещества в газообразном состоянии. Эмиссионный спектральный анализ позволяет определить элементарный состав неорганических и органических веществ.
Интенсивность спектральной линии определяется количеством возбужденных атомов в источнике возбуждения, которое зависит не только от концентрации элемента в пробе, но и от условий возбуждения. При стабильной работе источника (электрическая дуга, искра, пламя) возбуждения связь между интенсивностью спектральной линии и концентрацией – линейна и можно использовать метод градуировочного графика. Методом определяют свыше сорока элементов (щелочные, щелочно-земельные, медь, марганец и др.)
Атомно-абсорбционная спектроскопия. Метод основан на способности свободных атомов элементов в газах пламени поглощать световую энергию при характерных для каждого элемента длинах волн. Практически полностью исключена возможность наложения спектральных линий различных элементов, т.к. их число в спектре значительно меньше, чем в эмиссионной спектроскопии. Уменьшение интенсивности резонансного излучения подчиняется экспоненциальному закону. Аналогичному закону Бугера-Ламберта-Бера. Разработаны методики более чем для 70 элементов. Арбитражный метод для большинства микроэлементов. Иногда необходимо предварительное концентрирование или использование графитовой кюветы, или и то и другое.
Электрохимические методы. Ионометрия. Ионометрия используется для определение ионов K, Na, Ca, Mg, F, I, Cl и т.д. Метод основан на использовании ионселективных электродов, мембрана которых проницаема для определенного типа ионов (отсюда высокая селективность, как правило). Используют либо калибровочный график (Е-рС), либо метод добавок.
Полярография. Переменно-токовую полярографию используют для определения ртути, кадмия, свинца, меди, железа. Метод основан на изучении вольтамперных кривых, полученных при электролизе окисляющегося или восстанавливающегося вещества. Электрод – чаще всего ртутный капельный, иногда – платиновый, графитовый.
2.7.1. Макроэлементы
Кальций (от лат. calcium – Ca). Кальций составляет (вместе с фосфором) основу костной ткани и зубов, входит в состав ядер клеток, клеточных и тканевых жидкостей, активизирует деятельность ряда важных ферментов, участвует в поддержании ионного равновесия в организме, влияет на процессы, происходящие в нервно-мышечной и сердечно-сосудистой системах, обеспечивает процесс свертывания крови; участвует в передаче нервных импульсов, передаче сигналов через клеточную мембрану, сокращении мышц, деятельности мышцы сердца. Таким образом, кальций выполняет не только пластические функции, но и влияет на многие биохимические и физиологические процессы в организме.
Кальций относится к трудно усваиваемым элементам. Поступающие в организм человека с пищей соединения кальция практически нерастворимы в воде. Щелочная среда тонкого кишечника способствует образованию трудно усваиваемых соединений кальция, и лишь воздействие желчных кислот обеспечивает его всасывание.
Потребность взрослых людей в кальции – около 800 мг, а для детей и подростков – 1000 и более мг в сутки. Больше всего кальция в молоке (120 мг%) и молочных продуктах. При недостаточном потреблении кальция или нарушении его всасывания в организме (при недостатке витамина D) развивается состояние кальциевого дефицита. Наблюдается повышенное выведение его из зубов и костей. У взрослых развивается остеопороз – деминерализация костной ткани, у детей нарушается становление скелета, развивается рахит.
Почти 4/5 всей потребности в кальции удовлетворяется молочными продуктами. Это – лучшие источники кальция (сыры, творог – 100–1000 мг/100 г продукта). Значительно меньше кальция в яйцах, мясе, рыбе, овощах, фруктах, ягодах (20–40 мг%). Следует отметить, что в некоторых растительных продуктах содержатся вещества, уменьшающие всасывание кальция. Например, фитиновые кислоты, содержащиеся в злаковых, и щавелевая кислота в щавеле и шпинате. В результате взаимодействия этих кислот с кальцием образуются нерастворимые фитаты и оксалаты кальция.
Магний (от лат. magnesium – Mg). Магний – жизненно важный элемент, участвующий в формировании костей, регуляции работы нервной ткани, в обмене углеводов и энергетическом обмене, активизирует ряд ферментов, участвует в поддержании нормальной функции нервной системы и мышцы сердца, оказывает сосудорасширяющее действие, повышает двигательную активность кишечника, что способствует выведению шлаков из организма (в том числе и холестерина).
Усвоению магния мешает наличие фитина и избыток жиров и кальция в пище.
Потребность точно не определена. Считают, что доза 200–300 мг/сут предотвращает появление недостаточности (предполагается, что всасывается около 30% магния). Ранее считали, что суточная потребность составляет 400 мг.
При недостатке магния нарушается усвоение пищи, задерживается рост, в стенках сосудов откладывается кальций. У человека недостаток ионов магния, обусловленный характером питания, маловероятен.
Магнием богаты в основном растительные продукты. Большое количество его содержат пшеничные отруби, крупы (40–200 мг%), бобовые, курага, чернослив. Мало магния в молочных продуктах, мясе, рыбе, макаронных изделиях, большинстве овощей и фруктов (20–40 мг%). Почти 1/2 нормы удовлетворяется хлебом и крупяными изделиями. В некоторых важных процессах магний выступает как антагонист кальция, избыток магния снижает усвояемость кальция. Оптимальное соотношение кальция и магния 1:0,7 (0,5).
Определение кальция и магния. Определение кальция и магнияпроводят, как правило, одним и тем же методом. Метод основан на комплексонометрическом определении с помощью трилона Б. Кальций определяют при рН 13, магний – в той же пробе дополнительным титрованием при рН 10.
Для подготовки пробы используется как простое сухое, так и мокрое озоление. Мокрое озоление проводят азотной и хлорной кислотами. Использование серной кислоты не допускается из-за образования нерастворимого осадка сульфата кальция. Золу растворяют в разбавленной соляной кислоте.
Проведение определения.
1.Установление титра трилона Б. Титр устанавливается по эталонному раствору хлорида кальция или хлорида магния. Например, титруют раствор соли магния в присутствии аммиачного буфера и хромогена раствором ЭДТА до перехода окраски из вишневой в синюю.
2.Определение кальция. К исследуемому раствору, который при необходимости разбавляют, добавляют КОН или NaОН до рН 13 и индикатор (эриохром черный, мурексид, хромоген темно-синий). Раствор титруют 3 раза до перехода розовой или малиновой окраски в темно-синюю или фиолетовую, в зависимости от индикатора.
3.Определение магния. Обычно магний определяют в той же колбе, что и кальций. Жидкость подкисляют до рН 11,5–12 разбавленной (1:1) соляной кислотой, добавляют аммиачный буфер (рН должно быть 10), добавляют раствор диэтилдитиокарбамата натрия для связывания тяжелых металлов и титруют раствором трилона до перехода окраски в сине-голубую. Дополнительное количество трилона, пошедшее на титрование, соответствует содержанию магния в пробе. Иногда определяют сумму кальция и магния в отдельной пробе. Щелочью доводят рН до 10, добавляют аммиачный буфер, индикатор, диэтилдитиокарбамата натрия и титруют трилоном Б. Содержание магния определяют по разности между вторым (сумма кальция и магния) и первым (кальций) титрованием.
При наличии необходимого оборудования кальций и магний определяют атомно-абсорбционным методом.
Дитиокарбаматы – соли дитиокарбаминовых кислот. Соли аммония, щелочных металлов растворимы в воде. Соли Mn, Fe, Co, Ni, Pb, Hg, Zn не растворимы в воде. Дитиокарбамат натрия (купраль) используется в аналитической химии (концентрирование, маскирование, разделение).
 Дитиокарбаматы Дитиокарбаматы
|
Объемный метод определения кальция. Объемный метод определения кальцияоснован на осаждении кальция насыщенным раствором (NH4)2C2O4 (щавелевокислого аммония). Отцентрифугированный и отмытый осадок оксалата кальция растворяют в минеральной кислоте. Образовавшуюся при этом щавелевую кислоту титруют раствором перманганата калия.
Ca2+ + C2O42– ® CaC2O4¯
CaC2O4 + 2HCl ® CaCl2 + H2C2O4
2MnO4– + 5C2O42– + 16H+ ® 2Mn2+ + 10CO2 + 8H2O
Для определения малых концентраций используют атомно-абсорбционный анализ (характеристические длины волн для кальция – 422,7, магния – 285,2 нм), эмиссионный, флуоресцентный анализ, чувствительность которых 10–2–10–6 мас.%.
Ионообменная хроматография. Для определения кальция и магния успешно используется ионообменная хроматография. Метод основан на обратимом стехиометрическом обмене ионов, находящихся в растворе, на ионы, входящие в состав ионообменника (катионита, анионита), а также на различной способности разделяемых ионов к ионному обмену с фиксированными ионами сорбента, образующимися в результате диссоциации ионогенных групп сорбента. Разделение ионов регулируют подбором рН элюента. Ионообменная хроматография позволяет определять в одной пробе ионы Са2+, Na+, К+, М g2+, NH4+.
Фосфор (от лат. phosphorus – P). Фосфор – важнейший элемент, входящий в состав белков, нуклеиновых кислот, костной ткани, мышц. Кроме того, соединения фосфора принимают участие во всех процессах жизнедеятельности организма: в обмене энергии (аденозинтрифосфорная кислота и креатинфосфат являются аккумуляторами энергии, при их гидролизе в клетке выделяется большое количество энергии); синтезе и расщеплении веществ в клетках; регуляции обмена веществ. С превращениями соединений фосфора связаны мышечная и умственная деятельность, жизнеобеспечение организма.
В тканях организма и пищевых продуктах фосфор содержится в виде фосфорной кислоты и ее органических соединений. Содержание органических соединений фосфора в крови меняется в широких пределах. Однако количество неорганического фосфора более или менее постоянно.
Потребность для взрослых – 1200 мг/сут. Она возрастает при больших физических и умственных нагрузках, при некоторых заболеваниях.
Большое количество фосфора содержится в продуктах животного происхождения, особенно в печени, икре, а также в зерновых и бобовых. В этих продуктах от 100 до 500 мг% фосфора. Богатым источником фосфора являются крупы (овсяная, перловая), в них до 300–350 мг%. Однако из растительных продуктов соединения фосфора усваиваются хуже, чем при потреблении пищи животного происхождения. Основное количество фосфора человек потребляет с молоком и хлебом. При избытке фосфора может происходить выведение кальция из костей: образуются растворимые соли, которые извлекаются кровью из костной ткани. Оптимальное соотношение фосфора и кальция 1:1,5. Трудно соблюсти это соотношение, т.к. большинство потребляемых продуктов значительно богаче фосфором, чем кальцием.
В зависимости от содержания фосфора в продукте используют две группы методов для его определения – весовые и колориметрические. Весовые методы более точны, лучше воспроизводимы, т.к. состав осадка с хинолином, используемым при осаждении, практически постоянен, однако эти методы весьма длительны. Колориметрические методы менее трудоемки, чем весовые, но требуют для получения хорошей воспроизводимости тщательного соблюдения условий протекания реакций (рН, температуры). Колориметрические методы более чувствительны, чем весовые, и поэтому часто используются при анализе продуктов, содержащих мало фосфора.
Подготовка пробы. Так как некоторые соединения фосфора летучи, для большинства пищевых продуктов рекомендуется мокрое озоление с помощью кислот. Наиболее распространенными способами минерализации являются: окисление продукта азотной и серной кислотами, смесью серной кислоты с перекисью водорода. Допускается сухое озоление, но только в присутствии нитратов, связывающих фосфор. Простое сухое озоление не допускается.
Весовой метод. Принцип метода основан на выделении фосфора в виде осадка с помощью хинолин-молибдатного реактива. Далее осадок взвешивают (гравиметрическое окончание) или количество фосфора определяют титриметрически по количеству щелочи, пошедшей на нейтрализацию фосфорной кислоты (титриметрическое окончание).
Проведение определения. Готовят раствор осадителя, содержащий молибдата натрия, лимонную кислоту и азотную кислоту. Затем при перемешивании сливают этот раствор с раствором хинолина и оставляют на 24 часа. Затем фильтруют, добавляют ацетон и разбавляют водой. К минерализованной пробе добавляют раствор осадителя и кипятят 1 минуту, охлаждают при перемешивании и фильтруют под вакуумом через предварительно прокаленный и взвешенный фильтр. Промывают осадок водой. Фильтр сушат при температуре 260ºС (1 час), охлаждают в эксикаторе и взвешивают. Для определения фосфора массу осадка умножают на 0,014.
Молибдат аммония в азотнокислой среде образует с фосфатами желтый кристаллический осадок фосформолибдата аммония:
Na3PO4 + 3NH4Cl + 12(NH4)2MoO4 + 24HNO3 ®
® (NH4)3H4[P(Mo2O7)6]¯ + 10H2O + 24 NH4NO3 + 3NaCl
PO43– + 12MoO4– + 3NH4+ + 24H+ = (NH4)3H4[P(Mo2O7)6]¯ + 10H2O
Реакция с молибдатом аммония имеет несколько модификаций, основанных на способности фосфорномолибденовой кислоты образовывать нерастворимые осадки с органическими основаниями различного цвета. Так, при добавлении фосфатов к раствору молибдата дианизидина образуется коричневый осадок фосформолибдатат дианизидина, молибдат хинолина образует фосформолибдат хинолина ярко-желтого цвета. Реакции мешают восстановители.
 Хинолин – сильное основание и легко протонируется по атому азота, образуя с минеральными кислотами органические растворимые устойчивые соли.
Хинолин – сильное основание и легко протонируется по атому азота, образуя с минеральными кислотами органические растворимые устойчивые соли.
|
Титриметрический метод. Проведение определения: раствор, полученный после минерализации пробы смесью серной и азотной кислот нейтрализуют аммиаком до появления осадка, добавляют азотную кислоту, насыщенный раствор нитрата аммония и нагревают до 40°С. И при перемешивании приливают раствор молибдата аммония. Смесь перемешивают и оставляют на 1 час, фильтруют так, чтобы осадок остался в стакане. Осадок промывают 1%-ной азотной кислотой, водой до нейтральной среды промывных вод. Фильтр с осадком переносят в колбу, в которой проводилось осаждение, и добавляют туда точно фиксированное количество 0,1 н. раствора гидроокиси натрия для полного растворения осадка, разбавляют водой, добавляют фенолфталеин и избыток щелочи оттитровывают 0,1 н. раствором серной кислоты.
При использовании титриметрического метода определения фосфора возможно также осаждение фосформолибдата 8-гидроксихинолином. Полученный осадок, как и в предыдущем случае, растворяют в избытке щелочи, а избыток щелочи оттитровывают кислотой.
Колориметрические методы. Колориметрические методы более чувствительны, чем весовые, и позволяют анализировать продукты с низким содержанием фосфора. Существует две группы методов.
1.Ранее были широко распространены методы, основанные на образовании в кислой среде синего фосфорно-молибденового комплекса или так называемой «молибденовой сини». Молибденовые сини представляют собой ярко-синие вещества переменного состава, например, Mo8O23·8H2O, Mo4O11·H2O, Mo2O5·H2O. В присутствии фосфора образуется фосфорно-молибденовый комплекс H7{P(Mo2O7)OMo3O6}. Получают их действием восстановителей на растворы молибдатов. Сини поглощают при 620 нм. Восстановление проводят в мягких условиях, чтобы исключить восстановление содержащихся в растворе ионов МоО4– (гидразин, аскорбиновая кислота). Часто используется сложный реагент, содержащий (NH4)2MoO4, сульфат гидразина и серную кислоту в соответствующих концентрациях.
Методы, использовавшиеся для определения фосфора, отличались природой восстановителя: гидразин, пирокатехин, амидол. Однако эти методы оказались недостаточно воспроизводимыми, т.к. состав образующегося комплекса непостоянен. Поэтому в последнее время эти способы стали вытесняться колориметрическим методом, основанным на использовании молибденванадиевого реактива, который характеризуется значительно лучшей воспроизводимостью. Поэтому молибденванадиевый метод рекомендуется как более предпочтительный по сравнению с методами, основанными на образовании «молибденовой сини». Оптимальная кислотность при определении соответствует 0,5 н. При более высокой кислотности образование комплекса замедляется.
2.Метод с использованием молибденванадиевого реактива (метод фосфорнованадиево-молибденовой кислоты).Метод гостирован в Республике Беларусь.
Если к кислому раствору, содержащему анионы фосфат- и ванадат-ионы, прибавить молибдат, то образуется фосфорнованадиево-молибденовая гетерополиксилота (с соотношением P:V:Mo = 1:1:11) желто-оранжевого цвета (e = 20000, lмах = 315 нм). Раствор не должен содержать восстановителей.
Стадии определения: сухая минеральзация, растворение золы в соляной кислоте при нагревании, проведение реакции с молибденванадиевым реактивом, измерение интенсивности желтой окраски при помощи фотоэлектроколориметра или спектрофотометра.
Раствор, полученный после минерализации разбавляют в зависимости от содержания фосфатов, добавляют молибденванадиевый реактив (реактив содержит молибдат аммония, ванадат аммония и азотную кислоту). Через 5 мин измеряют оптическую плотность при 436 нм (кювета 1 см). Расчет производят по калибровочной прямой, содержащей не менее 5 точек. Для этого готовят стандартные растворы по дигидрофосфату калия, выдерживаемые после добавления реактива в течение 30 мин при температуре 20–30ºС. Раствором сравнения служит раствор, приготовленный, как и раствор для измерений, но не содержащий образца (холостой). Реакцию проводят при рН 0,5.
Несмотря на худшую воспроизводимость колориметрического метода по сравнению с весовым, он используется чаще, поскольку его применение позволяет значительно сократить время анализа. Весовой метод используется как арбитражный.
Для определения фосфора могут также использованы методы атомно-абсорбционного, люминисцентного анализа, ЯМР и др.
Натрий (от лат. natrium – Na). Натрий – жизненно важный межклеточный и внутриклеточный элемент (играет важную роль в процессах внутриклеточного и межтканевого обмена веществ). Содержится во всех тканях и биологических жидкостях организма. Участвует в создании необходимой буферности крови, регуляции кровяного давления, водного обмена (ионы натрия способствуют набуханию коллоидов тканей, что задерживает воду в организме), активации пищеварительных ферментов, регуляции нервной и мышечной ткани. Легко всасывается. Содержание Na в организме человека 1,4 г/кг.
Естественное содержание натрия в пищевых продуктах относительно невелико 15–80 мг%. Обычно взрослый человек потребляет 4–6 г, а то и 15 г натрия в день. Основное количество (свыше 80%) организм получает при потреблении продуктов, приготовленных с добавлением поваренной соли. Потребность в натрии минимально составляет 1 г/сут и она возрастает почти в 2 раза при сильном потоотделении в условиях жаркого климата, при сильных физических нагрузках. Растительная пища, особенно картофель, богата калием и усиливает выделение хлористого натрия с мочой, а следовательно, и повышает потребность в нем.
Избыточное потребление натрия с поваренной солью перегружает почки (ухудшается удаление конечных продуктов обмена) и сердце, способствует повышению кровяного давления, недостаток натрия также ведет к нарушениям.
Определение натрия с помощью пламенного фотометра. Определение натрия часто проводится с помощью пламенного фотометра. Поскольку во многих пищевых продуктах содержится много калия, который при некоторых условиях может мешать определению, это должно учитываться при определении. Ошибки незначительны при использовании спектрофотометров, в которых можно точно установить ширину щели (589 нм), и могут быть существенными при использовании фотометров с широкополосными фильтрами. Обычно определения калия и натрия совмещают. Для устранения помех можно добавлять в стандарты и в исследуемый раствор соли лития или цезия (1–2 г/л).
Для подготовки пробы используется как сухое, так и мокрое озоление. Эти методы используются в основном при определении естественного содержания натрия. При сухом озолении рекомендуется смешивать образец с разбавленной серной кислотой и доозолять с азотной кислотой. Зола растворяется в разбавленной соляной кислоте. Мокрое озоление рекомендуется проводить азотной и серной кислотами или азотной, серной и хлорной кислотами. Для пищевых продуктов, в которые добавлялся хлорид натрия, можно применять трехкратную экстракцию теплой водой тонкоизмельченного материала с последующим исследованием экстракта.
Проведение определения.
1. Определение на приборе с широкополосным фильтром. Готовят серию не менее 6 стандартов, которые следует хранить в посуде из полиэтилена. В начале и в конце анализа серии образцов строят калибровочную прямую, которую усредняют. По калибровочному графику находят содержание натрия.
2. Определение на спектрофотометре при 589 нм (наиболее интенсивная резонансная линия). Определение производится сериями из трех образцов, включая стандарт с более низким содержанием натрия, чем у исследуемого образца, стандарт с более высоким содержанием натрия и сам исследуемый образец (метод ограничивающих растворов). Расчет делают по формуле:
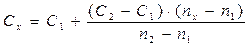
| где | С – | концентрация раствора; |
| n – | показание прибора; | |
| х – | индекс относящийся к анализируемому раствору; | |
| 1 и 2 – | индексы относящиеся к стандартным растворам с более низким и более высоким содержанием натрия, чем в исследуемом образце. |
В продуктах, богатых кальцием, возможны помехи, которые можно устранить только удалением кальция из исследуемого раствора, например с помощью осаждения в виде оксалатов.
В настоящее время для определения натрия все чаще используются атомно-абсорбционные методы. В этом случае помехи от присутствия кальция легко устранимы.
В отсутсвии пламенного фотометра определить натрий можно весовым методом, который основан на осаждении натрия цинкуранилацетатом (в уксуснокислой среде) в виде натрийцинкуранилацетата (NaZn(UO2)3(CH3COO)9·9H2O) зеленовато-желтого цвета.
Zn(UO2)3(CH3COO)8 + CH3COOH + NaCl + H2O ®
® NaZn(UO2)3(CH3COO)9¯ + HCl
Осадок высушивают и пересчитывают на натрий. Метод применим, если соотношение К:Na в продукте не более 25, т.к. при больших концентрациях калий тоже образует с реактивом осадок, что приводит к завышению результатов. Анализу мешают фосфат-ионы, которые удаляют 25%-ным раствором ацетата свинца. Избыток реактива убирают раствором сульфата магния.
При наличии необходимого оборудования натрий может быть определен методами атомно-абсорбционной спектрокопии и ионообменной хроматографии.
Калий (от лат. kalium – K ). Калий – жизненно важный внутриклеточный элемент (90% калия находится внутри клеток), регулирующий кислотно-щелочное равновесие в крови. Он участвует в передаче нервных импульсов, активизирует работу ряда ферментов, регулирует осмотическое давление в клетке. В сыворотке крови содержится 20 мг% калия. Увеличение содержания калия в сыворотке приводит к угнетению автоматизма и сократительной способности миокарда. Уменьшение содержания калия увеличивает опасность аритмии. Калий хорошо всасывается из кишечника, а его избыток быстро удаляется из организма с мочой.
Считают, что калий обладает защитным действием против нежелательного влияния избытка натрия и нормализует давление крови. По этой причине в некоторых странах выпускают поваренную соль с добавлением хлорида калия.
Потребность взрослого человека – 2000–4000 мг/сут. Она увеличивается при обильном потоотделении, при употреблении мочегонных средств, заболеваниях сердца и печени. Дефицит калия при разнообразном питании не возникает.
Основной источник калия – растительные продукты. Среднее содержание калия в продуктах 150–170 мг%. Богаты калием: урюк, чернослив, изюм, шпинат, морская капуста, фасоль, горох (в фасоли – 1100, картофеле 570, яблоках и винограде – 250 мг%).
Метод пламенной фотометрии. Определение калия наиболее часто проводится с помощьюметода пламенной фотометрии. При некоторых условиях определению может мешать натрий. Для большинства пищевых продуктов содержание калия значительно превосходит содержание натрия, и поэтому учитывать его влияние на определение не требуется. Однако при приготовлении стандартов рекомендуется добавлять соли натрия в концентрации, близкой к ожидаемой.
Для подготовки пробы используется как сухое, так и мокрое озоление. Сухое озоление рекомендуется проводить как при определении натрия.
Определение проводят как и в случае определения натрия, только при определении калия на спектрофотометре устанавливают ширину щели 676 нм.
В последнее время для определения калия также используются атомно-абсорбционные спектрофотометры. Однако при своевременном устранении некоторых помех оба метода дают практически одинаковые результаты. ААС – чувствительность 0,01 мкг/мл; эмиссионная пламенная фотометрия – 10–4 мкг/мл.
Натр-кобальт-нитритный метод. При отсутствии возможности анализа с использованием пламенной фотометрии калий может быть определен натр-кобальт-нитритным методом. Метод состоит в том, что калий осаждается раствором гексанитрокобальтата натрия в виде труднорастворимой в воде тройной соли калия, натрия и кобальта. Полученная комплексная соль окисляется титрованным раствором перманганата калия, по расходу последнего определяется содержание калия в растворе.
К солянокислой вытяжке из золы добавляют раствор реактива при перемешивании и дают постоять не менее 30 минут (лучше 24 часа). Центрифугируют, отсасывают жидкость, промывают. К осадку добавляют точно измеренное количество 0,01 н. раствора перманганата калия и раствор 20% серной кислоты, размешивают и нагревают на водяной бане. По окончании реакции в колбу добавляют известный избыток 0,01 н. щавелевой кислоты. При этом раствор, имевший розовую окраску, обесцвечивается, т.е. избыток перманганата калия восстанавливается щавелевой кислотой. Избыток же щавелевой кислоты оттитровывают раствором перманганата калия.
Na3[Co(NO2)6] + 2KCl = K2Na[Co(NO2)6]¯ + 2NaCl
преимущественный состав
5K2Na[Co(NO2)6] + 12KMnO4 + 18H2SO4 = 5K2Na[Co(NO3)6] + 6K2SO4 + 12MnSO4 + Н2О
2MnO4– + 5C2O42– + 16H+ ® 2Mn2+ + 10CO2 + 8H2O
По уравнению реакции 1 мл 0,01 н. раствора перманганата калия соответствует 0,0651 г калия. Однако вследствие непостоянства состава осадка K2Na[Co(NO3)6] расход перманганата на окисление не постоянен. Здесь принят практически выведенный коэффициент 0,071.
Из общего количества раствора перманганата, израсходованного при определении, вычитают прибавленную щавелевую кислоту. Полученную разность умножают на 0,071 и получают содержание калия в мг в 1мл солянокислой вытяжки.
Тетрафенилборатный метод. Калий может быть также определен тетрафенилборатным методом. Ионы калия осаждаются тетрафенилборатом натрия в виде тетрафенилбората калия, который затем отфильтровывают, растворяют в ацетоне и определяют титрованием нитратом серебра.
K[B(C6H5)4] + AgNO3 = Ag[B(C6H5)4]¯ + KNO3
При наличии необходимого оборудования калий может быть определен методами атомно-абсорбционной спектрокопии и ионообменной хроматографии.
Хлор (от лат. chlorum – Cl ). Хлор – жизненноважный элемент, участвующий в образовании желудочного сока, формировании плазмы, активизирует ряд ферментов. Легко всасывается. Интересна способность хлора отлагаться в коже, задерживаться в организме при избыточном поступлении, выделяться с потом в значительных количествах.
Нарушения в обмене хлора ведут к развитию отеков, недостаточной секреции желудочного сока. Резкое уменьшение содержания хлора в организме может привести к тяжелому состоянию, вплоть до смертельного исхода. Повышение его концентрации в крови наступает при обезвоживании организма, а также при нарушении выделительной функции почек.
Естественное содержание хлора в пищевых продуктах колеблется в пределах 2–160 мг%. Потребность – около 5 г/сут. Безвредная доза до 5–7 г. Основное его количество человек получает с поваренной солью.
Из-за невысокого естественного содержания хлора в продуктах, его обычно определяют только в продуктах, в которые добавлена поваренная соль. Также как и при определении натрия, в этих случаях вместо минерализации допускается экстрагирование хлора горячей водой. При необходимости исследовать естественное содержание хлора используются специальные методы мокрой и сухой минерализации с последующим осаждением хлора нитратом серебра (весовым или титриметрическим методом).
Сера (от лат. sulfur – S ). Значение этого элемента в питании определяется в первую очередь тем, что она входит в состав белков в виде серусодержащих аминокислот (метионина, цистеина, цистина), а также в состав некоторых гормонов и витаминов. Как компонент серосодержащих аминокислот сера участвует в процессах белкового обмена, причем потребность в ней резко возрастает в период беременности и роста организма, сопровождающихся активным включением белков в образующиеся ткани, а также при воспалительных процессах. Серосодержащие аминокислоты, особенно в сочетании с витаминами С и Е, оказывают выраженное антиоксидантное действие. Наряду с цинком и кремнием сера определяет функциональное состояние волос и кожи.
Содержание серы обычно пропорционально содержанию белков в пищевых продуктах, поэтому ее больше в продуктах животного происхождения, чем растительного. Потребность человека в сере (около 1 г/сут, есть данные 400–600 мг) удовлетворяется обычным суточным рационом.
Определение так называемой общей серы в пищевых продуктах проводится очень редко (за исключением тех случаев, когда соединения серы вводятся в продукт специально). Это объясняется тем, что сера в значительной мере связана с белком и в определенной степени характеризует его содержание. Для многих продуктов соотношение белок: сера настолько постоянно, что по содержанию серы можно судить о количестве белка, и наоборот.
2.7.2. Микроэлементы
Общая характеристика. Важнейшими микроэлементами, определение которых в продуктах питания проводится наиболее часто, являются железо, цинк, йод и фтор. Вместе с тем проводятся довольно широкие исследования по определению содержания в пищевых продуктах меди, никеля, хрома, марганца, молибдена и ряда других микроэлементов, которые позволили бы более точно установить их роль в питании человека.
Большой успех в изучении микроэлементов в пищевых продуктах связан с успехами инструментальных методов анализа, в том числе эмиссионной спектроскопии, атомной абсорбции, полярографии. Сначала большие надежды возлагались на методы эмиссионной спектроскопии, позволявшей из одной пробы проводить анализ большого числа элементов. Однако вскоре выяснилось, что на количественное определение сильно влияет присутствие многих элементов в пробе («матричный эффект»). Для устранения этого эффекта рекомендуется готовить эталоны («основы») очень сложного состава, который сильно варьирует в зависимости от вида продукта. При этом правильность приготовления эталонов рекомендуется проводить двумя независимыми методами (химическими, атомно-абсорбционными и др.) Это сильно усложнило анализ, а без учета «матричного эффекта» метод эмиссионной спектроскопии для многих элементов дает ряд серьезных погрешностей.
В последние годы для определения микроэлементов все больше используются методы атомной абсорбции. Приборы, обладающие коррекцией фона и так называемой «зеемановской коррекцией» позволяют определять в пищевых продуктах до 20 элементов.
Для определения таких микроэлементов, как медь, цинк, свинец и кадмий, в пищевых продуктах успешно используется переменнотоковая полярография. В качестве примера можно привести последовательность действий при определении меди, олова и свинца в консервах полярографическим методом:
1. Навеску исследуемого продукта, помещенную в фарфоровую чашку, высушивают в сушильном шкафу и озоляют серной кислотой в муфеле при 450–500ºС;
2. Золу обрабатывают концентрированной HCl выпаривая на водяной бане; разбавляют водой и добавляют 25% аммиак, доводят до метки, фильтруют. В этом растворе определяют содержание меди.
3. Оставшийся на фильтре осадок содержит гидраты окисей свинца и олова. Осадок растворяют в соляной кислоте (1:1). После растворения осадка к раствору добавляют виннокаменную кислоту, сернистокислый натрий и нагревают на водяной бане до удаления запаха сернистого ангидрида. Раствор охлаждают и нейтрализуют концентрированным аммиаком, разбавляют, фильтруют. Раствор используют для определения свинца, а осадок на фильтре – для определения олова.
4. Осадок, содержащий олово, растворяют в разбавленной HCl и используют для определения олова.
Содержание указанных элементов определяют по методу добавок (два определения: исследуемый раствор и исследуемый раствор с добавкой данного металла). При анализе для каждого элемента создаются специфические условия полярографирования (чувствительность гальванометра, скорость истечения ртути, напряжение, фон). По высотам волн на полученных полярограммах вычисляют содержание каждого металла.
Хотя методы ААС, АЭС постепенно вытесняют колориметрические, все же еще остается немало микроэлементов, для которых колориметрические методы более чувствительны. Это – мышьяк, селен, фтор, алюминий. Молибден, кобальт и олово (в консервах) могут определяться как атомной абсорбцией, так и колориметрическими методами. Для йода наиболее подходящими методами являются объемные. Сложной задачей в анализе микроэлементов является подготовка пробы (минерализация) пищевых продуктов и методы количественной характеристики анализируемых элементов. Хотя сухая минерализация более удобна, так как не загрязняет исследуемый раствор следами микроэлементов, содержащимися в кислотах при мокром озолении, в присутствии хлоридов, как уже отмечалось, наблюдается потеря микроэлементов (Al, Cr, Zn, Fe).
Железо (от лат. ferrum – Fe ). Железо – жизненно важный элемент. Оно задействовано в процессах кроветворения, участвует в образовании гемоглобина. Железо также входит в состав ферментов пероксидазы и каталазы, является неотъемлемой составной частью цитохромной системы организма, участвует в процессе тканевого дыхания. Железо присутствует в организме человека в количестве 4–5 г. Усвоению железа препятствует щавелевая кислота и фитин. Для усвоения железа необходим витамин В12; способствует усвоению железа также и аскорбиновая кислота, восстанавливающая железо до ионов Fe2+, в виде которых оно и всасывается.
Недостаток железа может привести к развитию тяжелого заболевания – железодефицитной анемии, нарушению клеточного дыхания. Потребность – 14 мг/сут, с избытком удовлетворяется обычным рационом. Однако при использовании в питании хлеба из муки тонкого помола, содержащего немного железа, у городских жителей весьма часто наблюдается дефицит железа. При этом следует учесть, что зерновые продукты богатые фитином и фосфатами, образуют с железом трудно растворимые соли и снижают его усвояемость организмом. Из зерновых продуктов усваивается человеком всего 5–10% железа, тогда как из мясных до 30% этого элемента. Другими словами, люди, страдающие железодефицитной анемией, должны потреблять больше мяса. Чай снижает усвояемость железа в результате связывания его с дубильными веществами в трудно расщепляемый комплекс.
Хотя железо является жизненно важным элементом, его избыток в питании нежелателен и поэтому в ряде продуктов содержание железа лимитируется. Осведомленность населения о железодефицитной анемии привела к популярности и широкому использованию препаратов и пищевых добавок, содержащих железо. Однако следует помнить, что избыточный прием таких железосодержащих веществ может вызвать тяжелую интоксикацию, особенно у детей (гемохроматоз). При гемохроматозе нарушаются механизмы, ограничивающие всасывание железа. В результате железо распределяется и накапливается во всех органах, особенно в печени и поджелудочной железе. В связи с этим возникают нарушения в работе печени (цирроз), развивается сахарный диабет, сердечная недостаточность и другие столь же неприятные болезни. Железо становится опасным при потреблении его более 200 мг в день.
Содержание железа в пищевых продуктах колеблется в пределах 70–4000 мкг%. Так содержание железа в мясе составляет 2–3 мг%, в молоке – 67 мкг%, в ржаном хлебе – 3,9 мг%, в яблоках – 2,2 мг%. Особенно много железа в почках, печени (2000 мг%) и бобовых (6000–20000 мкг%), яичном желтке, овощах, ягодах. Лучше всего железо усваивается из мяса.
Железо окисляет пищевые продукты гораздо сильнее, чем медь, и его избыток в продуктах портит их внешний вид и вкус. В связи с высокой окислительной способностью железа его содержание, как и меди, в продуктах нормируют на более низком уровне, чем это необходимо по токсикологическим свойствам.
Фотометрический метод с орто-фенантролином. Для определения железа рекомендуется использовать весьма чувствительный и избирательный фотометрический метод с орто-фенантролином(гостирован в Республике Беларусь). Поскольку с этим реактивом реагируют только ионы двухвалентного железа, то трехвалентное железо предварительно переводят в двухвалентное добавкой восстановителя (аскорбиновой кислоты, гидрохинона, сернистой кислоты). Реакция протекает при рН 2–9, лучше при рН 4–6. Для создания необходимого рН используют ацетат натрия. Для подготовки пробы используют как сухое, так и мокрое озоление. В связи с тем, что некоторые соединения железа, например, хлориды, летучи, при озолении их переводят в менее летучие нитраты. Для приготовления стандартного раствора железа используют соль Мора (NH4)2Fe(SO4)2·6H2O и серную кислоту. Для построения градуировочного графика готовят серию стандартных растворов (8 растворов) с концентрацией от 100 до 1600 мкг/л. В мерные колбы, содержащие необходимое количество стандартного раствора соли Мора, добавляют солянокислый или сернокислый раствор гидроксиламина. Доводят рН до 4–6 добавляя ацетат натрия. Затем в колбы вносят 0,25%-ный раствор орто -фенантролина (одинаковые объемы) и доводят до метки дистиллированной водой. Перемешивают и фотометрируют при 508 нм (e = 1,1×104). В качестве раствора сравнения используют все компоненты, исключая раствор железа.
о -Фенантролин (1,10) – органическое основание. Используют раствор о-фенантролина в 0,1Н соляной кислоте. о -Фенантролин быстро образует с ионами железа (2+) в широкой области рН оранжево-красный или розовый катионный комплекс (1:1).
|
Арбитражным методом определения железа в пищевых продуктах является метод атомно-абсорбционной спектроскопии.
Медь (от лат. cuprum – Cu ). Медь – необходимый в метаболизме элемент. В опр
 2015-10-13
2015-10-13 2652
2652