Основными параметрами, определяющими состояние газа, являются давление, температура и плотность или удельный объем.
Давлениегаза р обусловлено суммой сил ударов беспорядочно движущихся молекул газа о стенки сосуда, занятого этим газом, и численно равно величине нормальной составляющей силы, действующей на единицу поверхности, с которой соприкасается газ.
Р=F/f (1)
где F - нормальная составляющая силы; f - площадь, на которую действует сила.
Основными единицами измерения давления являются: в сиcтеме единиц МКГСС (метр, килограмм-сила, секунда) - килограмм-сила на квадратный метр (кгс/м2); в Международной системе единиц СИ - ньютон на квадратный метр (н/м2). Под ньютоном понимается сила, сообщающая находящейся в состоянии покоя массе в 1 кг ускорение 1 м/сек2, т. е. 1 н = 1 кг·1 м/сек2. В практике газоснабжения часто применяются внесистемные единицы измерения давления: килограмм-сила на квадратный сантиметр (кгс/см2), миллиметр водяного столба (мм вод. ст.), миллиметр ртутного столба (мм рт. ст.). 1 кгс/см2 =10 000 кгс/м2 = 10 000 мм вод. ст. = 735,56 мм рт. ст. = 98 066,5 н/м2.
Воздух земной атмосферы своей массой оказывает на поверхность Земли и окружающие предметы давление, называемое атмосферным, или барометрическим. Величина его в значительной мере зависит от высоты места измерения и температуры воздуха. На уровне моря при температуре 0° барометрическое давление равно 760 мм.рт.ст. Такое давление называют нормальным атмосферным давлением.
760 мм рт. ст. = 10330 мм вод.=1,033 кгс/см2.
Если из сосуда удалять воздух, то в нем создается давлена ниже атмосферного - разрежение. При полном удалении воздуха из сосуда давление становится равным нулю. Давление, отсчитываемое от нуля, называется абсолютным (рабс) а давление, превышающее атмосферное (барометрическое), - избыточны (ризб). В уравнениях, связывающих параметры состояния газ; применяют абсолютное давление; манометры показывают избыточное давление.
рабс = рбар + ризб (2)
При измерениях разрежения (вакуума) соотношение (2) принимает вид
рабс = рбар - рвак (3)
Абсолютная температура Т, °К, характеризует степень нагретости тела. Измерение температуры можно производить а основании агрегатных изменений вещества под ее воздействие: В частности, в качестве исходных значений, служащих при построении Международной практической
температурной шкал Цельсия для установления начала отсчета температуры и единицы ее измерения - градуса, приняты температура плавления льда (0° С) и кипения воды (100° С) при нормальном атмосферном давлении. Температуры, лежащие выше 0° С, считают положительными, а лежащие ниже 0° С - отрицательными. В системе единиц СИ расчеты температуры производятся от абсолютного нуля в градусах термодинамической шкалы Кельвина. Абсолютный нуль этой шкалы (0° К) характеризуется прекращение теплового движения молекул вещества и соответствует по шкале Цельсия температуре - 273,15° С. Таким образом, обе шкалы различаются лишь начальной точкой отсчета, а цена деления (градуса) у них одинакова.
ТоК=tоС+273,15 (4)
Плотность ρ – количество массы вещества в единице объема.
ρ=m/V (5)
где m – масса вещества; V – объем вещества.
В системе СИ плотность измеряется в килограммах – массы на кубический метр (кг/м3). Подставив в формулу (5) выражение массы по закону Ньютона и соответствующие размерности, получим, что размерность плотности в системе единиц МКГСС кгс·сек2/м4. При расчетах следует помнить, что 1 кгс·сек2/м4≈9,8 кг/м3.
Относительная плотность газа (по воздуху) s – отношение плотности газа к плотности воздуха при нормальных условиях.
s=ρ/1,293=0,733ρ (6)

Если считать газ идеальным, то при Т=273,16 К, Р=0,1 МПа и V=22,414 мл масса т равна молекулярной массе М газа. В тех же условиях масса 22,414 мл воздуха составляет 28,9 г, откуда относительная плотность газа или пара относительно воздуха равна
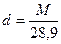 (7)
(7)
Абсолютную плотность газов и паров (ρ, кг/м3) при нормальных условиях можно найти, зная массу М и объем 1 моль газа (22,414 л)
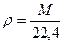 (8)
(8)
При абсолютной температуре Т (К) и давлении П (105 Па) плотность газа (в кг/м3) может быть найдена по формуле
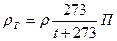 (9)
(9)
Используя формулу (8), можно написать
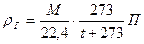
или
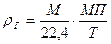 (10)
(10)
Средняя плотность смеси идеальных газов
ρсм= r1ρ1+ r2ρ2+....+ rnρn (11)
где r1, r2,….., rn – объемное (или молярное) содержание каждого компонента в смеси в долях единицы; ρ1, ρ2,….., ρn – плотности компонентов смеси.
Удельный объем υ – объем единицы массы вещества – величина, обратная плотности.
υ=V/m=1/ρ (12)
Критические параметры (табл.1) характеризуют критическое состояние газа, при котором плотность жидкой и паровой фаз газа одинакова. Сжатием и охлаждением до определенной температуры газы могут быть переведены в жидкое состояние. Однако для каждого газа существует определенная критическая температурa, выше которой газ никаким давлением не может быть сжижен. Давление, необходимое для сжижения газа при критической температуре, называют критическим давлением. Чем температура газа ниже критической, тем при меньшем давлении этот газ может быть сжижен. Объем газа, занимаемый при критических давлении температуре, называют критическим объемом.
Отношение фактических параметров газа ρ, Т и υ к критическим ρкр, Ткр и υкр называют приведенными параметрами состояния газа, т.е.
ρпр= ρ/ ρкр; Тпр=Т/Ткр; υпр= υ/ υкр (13)
Таблица 1
 2015-10-13
2015-10-13 17750
17750
