Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. В расширенной модели идеального газа частицы, из которого он состоит, имеют также форму в виде упругих сфер или эллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц
Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
· Диаметр молекулы  пренебрежимо мал по сравнению со средним расстоянием между ними (
пренебрежимо мал по сравнению со средним расстоянием между ними ( ) [7][8].
) [7][8].
· Импульс передается только при соударениях, то есть, силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях.
· Суммарная энергия частиц газа постоянна если нет передачи тепла или совершения газом работы.
В этом случае частицы газа движутся независимо друг от друга, давление газа на стенку равно сумме импульсов в единицу времени, переданной при столкновении частиц со стенкой, энергия — сумме энергий частиц газа.
По эквивалентной формулировке идеальный газ - такой газ, который одновременно подчиняется закону Бойля — Мариотта и Гей-Люссака[8], то есть:

где 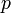 — давление,
— давление, 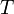 — абсолютная температура. Свойства идеального газа описываются уравнением Менделеева — Клапейрона
— абсолютная температура. Свойства идеального газа описываются уравнением Менделеева — Клапейрона
 ,
,
где 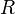 - универсальная газовая постоянная,
- универсальная газовая постоянная, 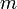 — масса,
— масса, 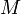 — молярная масса.
— молярная масса.
или

где  — концентрация частиц,
— концентрация частиц,  — постоянная Больцмана.
— постоянная Больцмана.
Для любого идеального газа справедливо соотношение Майера:

где 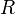 — универсальная газовая постоянная,
— универсальная газовая постоянная,  — молярная теплоемкость при постоянном давлении,
— молярная теплоемкость при постоянном давлении,  — молярная теплоемкость при постоянном объёме.
— молярная теплоемкость при постоянном объёме.
Молекулы вещества скрепляются межмолекулярными связями. Это свойство вещества связывать молекулы друг с другом силами притяжения между ними. Когда две молекулы или два атома вещества приближаются друг к другу, их уровень внутренней потенциальной энергии снижается до минимума. Расстояние между молекулами в точке, когда их потенциальная энергия является минимальной, называют расстоянием равновесия. Увеличение или уменьшение расстояния между молекулами за пределы расстояния равновесия требуют работы. Работа может подтолкнуть молекулы ближе друг к другу или растянуть их обособленно. Всякий раз, когда производится работа для сближения молекул, приложенная сила должна преодолеть быстро увеличивающуюся реактивную силу, которая называется упругость на сжатие. Точно так же любой работе, нацеленной на увеличение расстояния между молекулами, противостоят силы связи. Силы межмолекулярной связи, наибольшие в твердых телах, намного более слабы в жидкостях и фактически отсутствуют в газах.
Так как молекулы связаны друг с другом силами межмолекулярных связей, необходимо приложить внутреннюю работу для отделения их друг от друга. Когда материал расширяется, сжимается или изменяет физическое состояние, в ответ на работу или изменение энергии происходит перестановка молекул. В результате изменяется среднее расстояние между молекулами вещества. Следовательно, проделанная работа или передача энергии изменяет количество внутренней потенциальной энергии, сохраненной в веществе. Данное изменение сохраненной энергии никак не влияет на интенсивность колебаний молекул. Следовательно, кинетическая энергия остается постоянной в процессе изменения потенциальной энергии.
 2018-01-08
2018-01-08 3840
3840
