Важным энергетическим параметром для изучения химических процессов является энергия ионизации атома. Применительно к атому водорода это энергия, которую необходимо затратить, для того чтобы оторвать электрон от протона.
Она равна сумме потенциальной энергии системы и кинетической энергии электрона.
Ea= E+T= -Z.e/2.R, (2.7)
где Ea -энергия атома водорода.
Из формулы (2.7) следует, что уменьшение расстояния между электроном и ядром и увеличение заряда ядра означают увеличение силы притяжения электрона к ядру. То есть, потребуется больше энергии для отрыва электрона от ядра. Чем больше энергии требуется для разрыва этой связи, тем более стабильна система.
Следовательно, если разрушение связи (отделение электрона от ядра) в одной системе требует больше энергии, чем в другой, то первая система более стабильна.
Энергия ионизации атома - та энергия, что требуется для разрыва связей в атоме водорода, была определена экспериментально. Она равна 13,6 эВ (электронвольт). Также экспериментально была определена энергия, необходимая для отрыва электрона от ядра в атоме, состоящем из одного электрона и ядра, заряд которого в два раза больше, заряда ядра атома водорода. В этом случае необходимо затратить в четыре раза больше энергии (54,4 эВ).
|
|
|
Как известно из электростатики, энергия (Т), необходимая для разрыва связи между противоположенными зарядами (Z и е), находящимися друг от друга на расстоянии R, определяется равенством
T=Z.e/R (2.8)
Она пропорциональна величине зарядов и обратно пропорциональна расстоянию между ними. Такая корреляция вполне понятна: чем больше заряды, тем сильнее их притяжение друг к другу, следовательно, больше энергии требуется для разрыва связи между ними. И чем меньше расстояние между ними, тем больше энергии придется затратить на разрушение связи. Благодаря этому становится понятным, почему атомная система, где заряд ядра в два раза больше, чем заряд ядра в атоме водорода, более стабильна и требует больше энергии для отрыва электрона.
СРОДСТВО К ЭЛЕКТРОНУ частицы (молекулы, атома, иона), миним. энергия А, необходимая для удаления электрона из соответствующего отрицат. иона на бесконечность. Для частицы X С. к э. относится к процессу:

С. к э. равно энергии ионизации E отрицат. иона X-(первому потенциалу ионизации U1, измеряется в эВ). По аналогии с потенциалом ионизации различают первое и второе С. к э., а также вертикальное и адиабатическое С. к э. многоатомной частицы. Термрдинамич. определение С. к э.-стандартная энтальпия  р-ции (1) при абс. нуле температуры:
р-ции (1) при абс. нуле температуры:
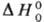 = АNА (NА~постоянная Авогадро).
= АNА (NА~постоянная Авогадро).
Надежных эксперим. данных по С. к э. атомов и молекул до сер. 60-х гг. 20 в. практически не существовало. В настоящее время использование равновесных методов получения и исследования отрицат. ионов позволило получить первые С. к э. для большинства элементов периодич. системы и неск. сотен орг. и неорг. молекул. Наиб. перспективные методы определения С. к э.-фотоэлектронная спектроскопия (точность + 0,01 эВ) и масс-спектрометрич. исследование равновесий ионно-молекулярных реакций. Квантовомех. расчеты С. к э. аналогичны расчетам потенциалов ионизации. Наилучшая точность для многоатомных молекул составляет 0,05-0,1 эВ.
|
|
|
Наибольшим С. к э. обладают атомы галогенов. Для ряда элементов С. к э. близко к нулю или меньше нуля. Последнее означает, что для данного элемента устойчивого отрицат. иона не существует. В табл. 1 приведены значения С. к э. атомов, полученные методом фотоэлектронной спектроскопии (работы У. Лайнебергера с сотрудниками).
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ, величина, характеризующая способность атома к поляризации ковалентных связей. Если в двухатомной молекуле А — В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным, чем А.
Л. Полинг предложил (1932) для количеств. характеристики электроотрицательности использовать термохим. данные об энергии связей А—А, В — В и А — В - соотв. ЕАА, Евв и ЕАВ. Энергия гипотетической чисто ковалентной связи А — В (Еков) принимается равной среднеарифметич. или среднегеометрич. значению величин EAA и ЕВВ. Если электроотрицательности атомов А и В различны, то связь А — В перестает быть чисто ковалентной и энергия связи ЕАВ станет больше Ековна величину 
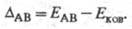
Чем больше различие электроотрицательностей  атомов А и В, тем больше величина
атомов А и В, тем больше величина  Используя эмпирич. ф-лу
Используя эмпирич. ф-лу  (множитель 0,208 возникает при переводе значений энергии из ккал/моль в эВ) и принимая для атома водорода произвольное значение электроотрицательности
(множитель 0,208 возникает при переводе значений энергии из ккал/моль в эВ) и принимая для атома водорода произвольное значение электроотрицательности  равное 2,1, Полинг получил удобную шкалу относит. числовых значений электроотрицательности, часть к-рых приведена в табл. Наиб. электроотрицателен самый легкий из галогенов - F, наименее - тяжелые щелочные металлы.
равное 2,1, Полинг получил удобную шкалу относит. числовых значений электроотрицательности, часть к-рых приведена в табл. Наиб. электроотрицателен самый легкий из галогенов - F, наименее - тяжелые щелочные металлы.
Для количеств. описания электроотрицательности, помимо термохим. данных, используют также данные о геометрии молекул (напр., метод Сандерсона), спектральные характеристики (напр., метод Горди).
АТОМНЫЕ РАДИУСЫ, эффективные характеристики атомов, позволяющие приближенно оценивать межатомное (межъядерное) расстояние в молекулах и кристаллах. Согласно представлениям квантовой механики, атомы не имеют четких границ, однако вероятность найти электрон, связанный с данным ядром, на определенном расстоянии от этого ядра быстро убывает с увеличением расстояния. Поэтому атому приписывают нек-рый радиус, полагая, что в сфере этого радиуса заключена подавляющая часть электронной плотности (90-98%). Атомные радиусы - величины очень малые, порядка 0,1 нм, однако даже небольшие различия в их размерах могут сказываться на структуре построенных из них кристаллов, равновесной конфигурации молекул и т.п. Опытные данные показывают, что во мн. случаях кратчайшее расстояние между двумя атомами действительно примерно равно сумме соответствующих атомных радиусов (т. наз. принцип аддитивности атомных радиусов). В зависимости от типа связи между атомами различают металлич., ионные, ковалентные и ван-дер-ваальсовы атомные радиусы.
Металлич. радиус равен половине кратчайшего расстояния между атомами в кристаллич. структуре металла. Его значение зависит от координац. числа К (числа ближайших соседей атома в структуре). Чаще всего встречаются структуры металлов с К = 12. Если принять значение атомных радиусов в таких кристаллах за 1, то атомные радиусы металлов с К, равными 8, 6 и 4, составят соотв. 0,98, 0,96 и 0,88. Близость значений атомных радиусов разл. металлов - необходимое (хотя и недостаточное) условие того, что эти металлы образуют твердые р-ры замещения. Так, жидкие К и Li (радиусы 0,236 и 0,155 нм соотв.) обычно не смешиваются, а К с Rb и Cs образуют непрерывный ряд твердых р-ров (радиусы Rb и Cs-соотв. 0,248 и 0,268 нм). Аддитивность металлич. атомных радиусов позволяет с умеренной точностью предсказывать параметры кристаллич. решеток интерметаллич. соединений.
|
|
|
Ионные радиусы используют для приближенных оценок кратчайших межъядерных расстояний в ионных кристаллах, предполагая, что эти расстояния равны сумме соответствующих ионных радиусов атомов. Существует неск. систем значений ионных радиусов, отличающихся для индивидуальных ионов, но приводящих к примерно одинаковым межъядерным расстояниям в ионных кристаллах. Впервые ионные радиусы были определены в 20-х гг. 20 в. В. М. Гольдшмидтом, опиравшимся на рефрактометрич. значения радиусов F- и О2-, равных соотв. 0,133 и 0,132 нм. В системе Л. Полинга за основу принято значение радиуса иона О2-, равное 0,140 нм, в распространенной системе Н. В. Белова и Г. Б. Бокия радиус этого же иона принят равным 0,136 нм, в системе К. Шеннона -0,121 нм (К = 2).
Ковалентный радиус равен половине длины одинарной хим. связи X—X, где Х - атом неметалла. Для галогенов ковалентный атомный радиус - это половина межъядерного расстояния в молекуле Х2, для S и Se- в Х8, для С-в кристалле алмаза. Ковалентные радиусы F, Cl, Br, I, S, Se и С равны соотв. 0,064, 0,099, 0,114, 0,133, 0,104, 0,117 и 0,077 нм. Ковалентный радиус водорода принимают равным 0,030 нм, хотя половина длины связи Н—Н в молекуле Н2 равна 0,037 нм. Пользуясь правилом аддитивности атомных радиусов, предсказывают длины связей в многоатомных молекулах. Напр., длины связей С—Н, С—F и С—С1 должны составлять 0,107, 0,141 и 0,176 нм соотв., и они действительно примерно равны указанным значениям во мн. орг. молекулах, не содержащих кратных углерод-углеродных связей; в противном случае соответствующие межъядерные расстояния уменьшаются.
|
|
|
Ван-дер-ваальсовы радиусы определяют эффективные размеры атомов благородных газов. Считают также, что эти радиусы равны половине межъядерного расстояния между ближайшими одинаковыми атомами, не связанными между собой хим. связью, т.е. принадлежащими разным молекулам, напр. в молекулярных кристаллах. Значения ван-дер-ваальсовых радиусов находят, пользуясь принципом аддитивности атомных радиусов, из кратчайших контактов соседних молекул в кристаллах. В среднем они на ~ 0,08 нм больше ковалентных радиусов. Знание ван-дер-ваальсовых радиусов позволяет определять конформацию молекул и их упаковку в молекулярных кристаллах. Энергетически выгодными обычно бывают такие конформации молекул, в к-рых перекрывание ван-дер-ваалъсовых радиусов валентно не связанных атомов невелико. Ван-дер-ваальсовы сферы валентно связанных атомов в пределах одной молекулы перекрываются. Внеш. контур перекрывающихся сфер определяет форму молекулы. Молекулярные кристаллы подчиняются принципу плотной упаковки, согласно к-рому молекулы, моделируемые своим "ван-дер-ваальсовым окаймлением", располагаются т. обр., что "выступы" одной молекулы входят во "впадины" другой. Пользуясь этими представлениями, можно интерпретировать кристаллографич. данные, а в ряде случаев и предсказывать структуру молекулярных кристаллов.
Билет 6.
Химическая связь.
Образование из атомов молекул, молекулярных ионов, ионов, кристаллических, аморфных и других веществ сопровождается уменьшением энергии по сравнению с невзаимодействующими атомами. При этом минимальной энергии соответствует определенное расположение атомов друг относительно друга, которому отвечает существенное перераспределение электронной плотности. Силы, удерживающие атомы в новых образованиях, получили обобщенное название ╚химическая связь╩. Важнейшие виды химической связи: ионная, ковалентная, металлическая, водородная, межмолекулярная.
Согласно электронной теории валентности, химическая связь возникает за счет перераспределения электронов валентных орбиталей, в результате чего возникает устойчивая электронная конфигурация благородного газа (октет) за счет образования ионов (В. Коссель) или образования общих электронных пар (Г. Льюис).
Химическая связь характеризуется энергией и длиной. Мерой прочности связи служит энергия, затрачиваемая на разрушение связи, или выигрыш в энергии при образовании соединения из отдельных атомов (Eсв). Так, на разрыв связи H√H затрачивается 435 кДжмоль√1, а на атомизацию метана CH4 √ 1648 кДжмоль√1, в этом случае EC√H = 1648: 4 = 412 кДж. Длина связи (нм) √ расстояние между ядрами в том или ином соединении. Обычно длина связи и ее энергия антибатны: чем больше длина связи, тем меньше ее энергия.
Химическая связь обычно изображается черточками, соединяющими взаимодействующие атомы; каждая черта эквивалентна обобщенной паре электронов. В соединениях, содержащих более двух атомов, важной характеристикой является валентный угол, образуемый химическими связями в молекуле и отражающий ее геометрию.
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность связи может быть выражена через ее дипольный момент м, равный произведению элементарного заряда на длину диполя *) м = e l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
*) Диполь √ система из двух равных, но противоположных по знаку зарядов, находящихся на единичном расстоянии друг от друга. Дипольный момент измеряется в кулон-метрах (Клм) или в дебаях (D); 1D = 0,33310√29 Клм.
Все эти факторы следует учитывать. Например, для линейной молекулы CO2 м = 0, но для SO2 м = 1,79 D вследствие ее углового строения. Дипольные моменты NF3 и NH3 при одинаковой гибридизации атома азота (sp3), примерно одинаковой полярности связей N√F и N√H (ОЭО N = 3; ОЭО F = 4; ОЭО H = 2,1) и сходной геометрии молекул существенно различаются, поскольку дипольный момент неподеленной пары электронов азота при векторном сложении в случае NH3 увеличивает м молекулы, а в случае NF3 уменьшает его.
Билет 7.
 2018-01-21
2018-01-21 8217
8217








