Задание 30
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сульфид серебра(I), азотная кислота, перманганат калия, сульфат аммония, ацетат стронция, нитрат железа(III). Допустимо использование водных растворов веществ
| 30 |
Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми сопровождается выделением бурого газа. Образования простого вещества в ходе данной реакции не происходит. Запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель.

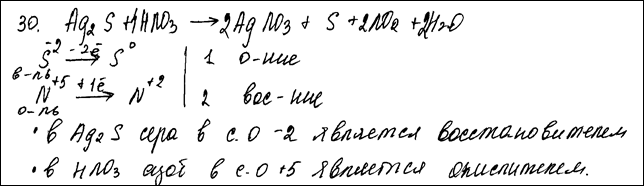
Комментарий: Использованы вещества из предложенного перечня.
Приведенное уравнение реакции не соответствует условию задания (образовалось простое вещество).
Второй элемент ответа не проверяется и не оценивается.
(0 баллов)
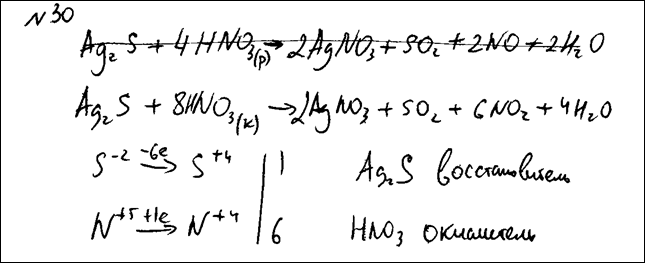
Комментарий: Использованы вещества из предложенного перечня.
Приведенное уравнение соответствует условию задания.
|
|
|
Коэффициенты расставлены верно.
Электронный баланс составлен (почти) верно; окислитель и восстановитель указаны верно.
(2 балла)
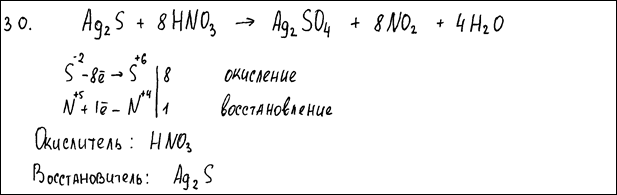
Комментарий: Использованы вещества из предложенного перечня.
Приведенное уравнение соответствует условию задания.
Коэффициенты расставлены верно.
Электронный баланс составлен верно; окислитель и восстановитель указаны верно.
(2 балла)
Задание 31
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сульфид серебра(I), азотная кислота, перманганат калия, сульфат аммония, ацетат стронция, нитрат железа(III). Допустимо использование водных растворов веществ.
Предлагаемый в приведенном перечне набор веществ позволяет составить несколько вариантов уравнений реакций ионного обмена. Уточнение условия задания (в КИМ ЕГЭ 2020 года), которое определяет классификационную принадлежность веществ или признаки протекания реакций, существенно ограничивает возможные варианты взаимодействий.
| 31 |
Из предложенного перечня веществ выберите слабую кислоту и вещество, которое вступает с этой кислотой в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.
| Вариант ответа: H2S + 2AgNO3 = 2HNO3 + Ag2S H2S + 2Ag+ + 2NO3– = 2H+ + 2NO3– + Ag2S H2S + 2Ag+ = 2H+ + Ag2S |
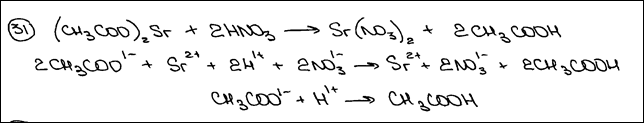
Комментарий: Приведенное уравнение реакции не соответствует условию задания (нужно было выбрать слабую кислоту). Все составленные уравнения реакций не проверяются.
(0 баллов)
| 31 |
Из предложенного перечня выберите два вещества, реакция ионного обмена между которыми сопровождается образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций.
|
|
|
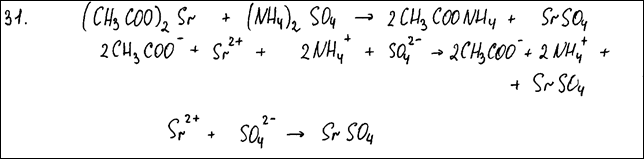
Комментарий: Молекулярное уравнение реакции составлено верно, в соответствии с условием задания.
Полное и сокращенное ионные уравнения реакций составлены верно.
(2 балла)
Задание 32
Соляную кислоту нейтрализовали карбонатом натрия. Полученный раствор подвергли электролизу. Газ, выделившийся на катоде, пропустили при нагревании над оксидом меди(II). Образовавшееся твёрдое вещество добавили к горячему раствору хлорида железа(III), при этом наблюдали растворение вещества. Напишите уравнения четырёх описанных реакций.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Вариант ответа:
1) Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
2) 2NaCl + 2H2O  2NaOH + H2 + Cl2
3) H2 + CuO 2NaOH + H2 + Cl2
3) H2 + CuO  Cu + H2O
4) Cu + 2FeCl3 Cu + H2O
4) Cu + 2FeCl3  2FeCl2 + CuCl2 2FeCl2 + CuCl2
| |
| Правильно записаны четыре уравнения реакций | 4 |
| Правильно записаны три уравнения реакций | 3 |
| Правильно записаны два уравнения реакций | 2 |
| Правильно записано одно уравнение реакции | 1 |
| Все уравнения реакций записаны неверно | 0 |
| Максимальный балл | 4 |
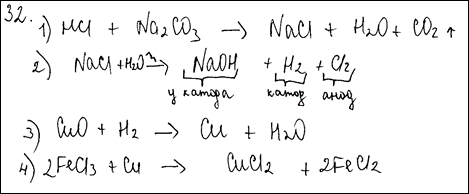
Комментарий: Ошибки допущены в первом и во втором уравнениях реакций: не расставлены коэффициенты.
(2 балла)
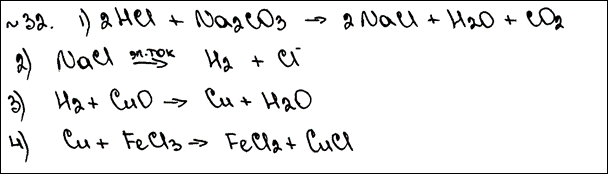
Комментарий: Уравнение 2 записано неверно. Уравнение 4 не соответствует условию задания: «… при этом наблюдали растворение вещества».
(2 балла)
Задание 33
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
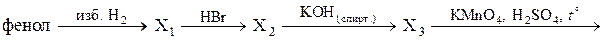
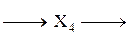
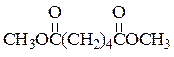
При написании уравнений реакций используйте структурные формулы органических веществ.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Вариант ответа:
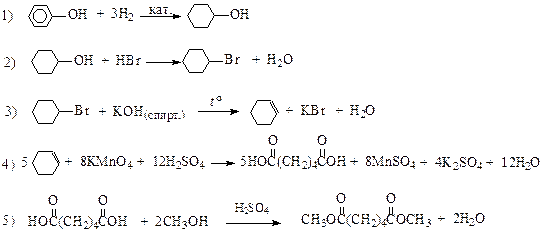
| |
| Ответ правильный и полный, включает все названные выше элементы | 5 |
| Правильно записаны четыре уравнения реакций | 4 |
| Правильно записаны три уравнения реакций | 3 |
| Правильно записаны два уравнения реакций | 2 |
| Правильно записано одно уравнение реакции | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 5 |
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
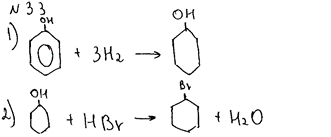
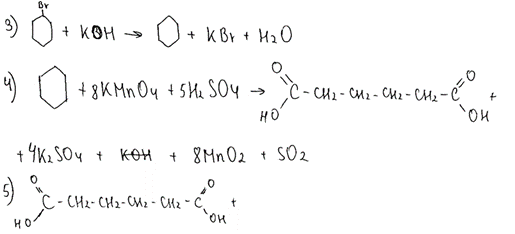
Комментарий: Верно составлены первое и второе уравнения реакций. Уравнения 3 и 4 записаны неверно, а 5 – отсутствует.
(2 балла)
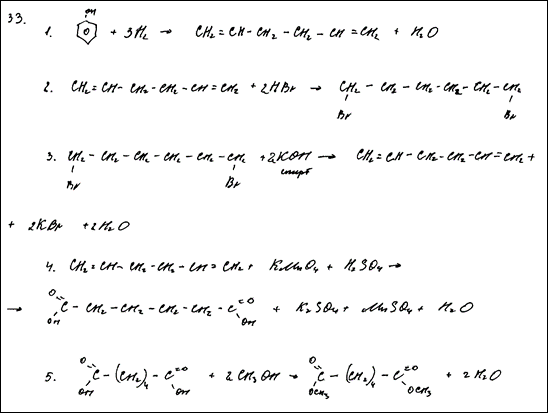
Комментарий: Уравнения 1 – 4 записаны неверно или не соответствуют заданной схеме превращений
(1 балл)
Задание 34
Для проведения электролиза (на инертных электродах) взяли 390 г 15%-ного раствора хлорида натрия. После того как масса раствора уменьшилась
на 21,9 г, процесс остановили. К образовавшемуся раствору добавили 160 г 20%-ного раствора сульфата меди(II). Определите массовую долю хлорида натрия в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи,
и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| Вариант ответа: 2NaCl + 2H2O = 2NaOH + Cl2↑ + H2↑ (электролиз) 2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 m(NaCl) = 390 ∙ 0,15 = 58,5 г n(NaCl) = 58,5 / 58,5 = 1 моль n(H2) = n(Cl2) = 21,9 / (2 + 71) = 0,3 моль n(NaOH обр.) = 2n(H2) = 0,6 моль m(CuSO4) = 160 ∙ 0,2 = 32 г n(CuSO4) = 32 / 160 = 0,2 моль n(NaCl прореаг.) = n(NaOH обр.) = 0,6 моль n(NaCl осталось) = 1,0 – 0,6 = 0,4 моль m(NaCl осталось) = 0,4 ∙ 58,5 = 23,4 г n(Cu(OH)2) = n(CuSO4) = 0,2 моль m(Cu(OH)2) = 0,2 ∙ 98 = 19,6 г m(р-ра) = 390 + 160 – 21,9 – 19,6 = 508,5 г w(NaCl) = 23,4 / 508,5 = 0,046, или 4,6% |
|
|
|
| Ответ правильный и полный, содержит следующие элементы: · правильно записаны уравнения реакций, соответствующих условию задания; · правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания; · продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которых проводятся расчёты; · в соответствии с условием задания определена искомая физическая величина | 4 |
| Правильно записаны три элемента ответа | 3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
Примечание. В случае, когда в ответе содержится ошибка в вычислениях, которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.

Комментарий: Верно составлены только два уравнения реакций (1 балл). Во втором и третьем элементах ответа допущены ошибки при определении количеств веществ и массы оставшегося хлорида натрия. Это привело к ошибке в расчете массы получившегося раствора. (1 балл)

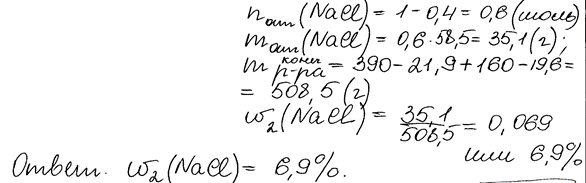
Комментарий: Верно записаны только два уравнения реакций. При установлении взаимосвязи данных, представленных в условии задания, с искомыми величинами нарушена логика, в результате чего, количество вещества и масса оставшегося в растворе хлорида натрия рассчитана неверно. В результате, искомая массовая доля раствора определена неверно.
(2 балла)
Задание 35
При сжигании образца органического вещества массой 1,85 г получено
1,68 л (н.у.) углекислого газа и 1,35 г воды.
Данное вещество подвергается гидролизу в присутствии серной кислоты; один из продуктов гидролиза вступает в реакцию «серебряного зеркала».
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
|
|
|
3) напишите уравнение гидролиза данного вещества в присутствии серной кислоты (используйте структурную формулу органического вещества).
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Вариант ответа:
1) Найдено количество вещества продуктов сгорания и определена молекулярная формула вещества:
n(CO2) = 1,68 / 22,4 = 0,075 моль; n(С) = 0,075 моль
n(H2O) = 1,35 / 18 = 0,075 моль; n(H) = 0,075 ∙ 2 = 0,15 моль
m(C + H) = 0,075 ∙ 12 + 0,15 ∙ 1 = 1,05 г
m(О) = 1,85 – 1,05 = 0,8 г
n(O) = 0,8 / 16 = 0,05 моль
n(С): n(Н): n(O) = 0,075: 0,15: 0,05 = 3: 6: 2
Молекулярная формула вещества – C3H6O2
2) Составлена структурная формула вещества:
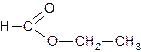 3) Составлено уравнение гидролиза:
3) Составлено уравнение гидролиза:
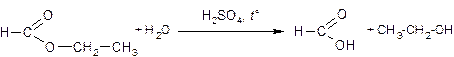
| |
| Ответ правильный и полный, содержит следующие элементы: · правильно произведены вычисления, необходимые для установления молекулярной формулы вещества, и записана молекулярная формула вещества; · записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания; · с использованием структурной формулы органического вещества записано уравнение реакции, на которую даётся указание в условии задания | 3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
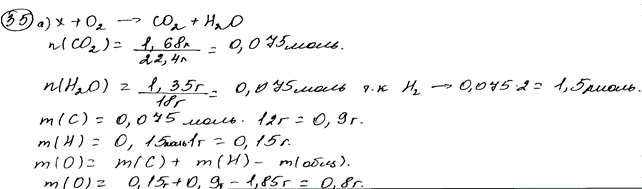
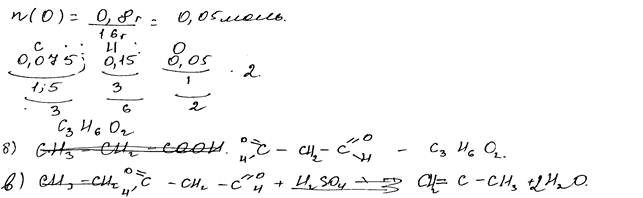
Комментарий: Расчеты для определения молекулярной формулы выполнены верно. Структурная формула вещества составлена без учета химических свойств, которые были указаны в условии задания.
(1 балл)
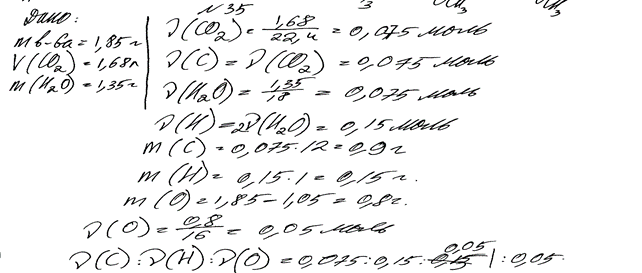
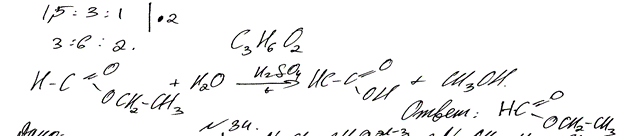
Комментарий: Ошибка допущена в записи формулы продукта химической реакции: вместо этилового записана формула метилового спирта. (2 балла)
Приложение 1
Обобщённый план варианта КИМ ЕГЭ 2020 года
по ХИМИИ
Уровни сложности заданий: Б – базовый; П – повышенный; В – высокий.
| Порядковый номер задания в работе | Проверяемые элементы содержания | Коды прове-ряемых элементов содержа-ния по кодифи-катору | Коды требо-ваний | Уро-вень слож-ности зада- ния | Макс. балл за вы-полнение зада-ния | При-мерное время выпол-нения задания (мин.) |
| Часть 1 | ||||||
| 1 | Строение электронных оболочек атомов элементов первых четырёх периодов: s -, p- и d -элементы. Электронная конфигурация атома.Основное и возбуждённое состояние атомов. | 1.1.1 | 1.2.1 2.3.1 | Б | 1 | 2–3 |
| 2 | Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И.Менделеева и особенностями строения их атомов | 1.2.1 1.2.2 1.2.3 1.2.4 | 1.2.3 2.4.1 2.3.1 | Б | 1 | 2–3 |
| 3 | Электроотрицательность. Степень окисления и валентность химических элементов | 1.3.2 | 1.1.1 2.2.1 | Б | 1 | 2–3 |
| 4 | Ковалентная химическая связь, её разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения | 1.3.1 1.3.3 | 2.2.2 2.4.2 2.4.3 | Б | 1 | 2–3 |
| 5 | Классификация неорганических веществ. Номенклатура неорганических веществ (тривиаль-ная и международная) | 2.1 | 1.3.1 2.2.6 | Б | 1 | 2–3 |
| 6 | Характерные химические свойства простых веществ-металлов: щелочных, щелочноземельных, магния, алюминия; переходных металлов: меди, цинка, хрома, железа. Характерные химические свойства простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния. Характерные химические свойства оксидов: оснóвных, амфотерных, кислотных | 2.2 2.3 2.4 | 2.3.2 2.3.3 | Б | 1 | 2–3 |
| 7 | Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот. Характерные химические свойства солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка). Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты. Реакции ионного обмена | 2.5 2.6 2.7 1.4.5 1.4.6 | 2.3.3 1.1.1 1.1.2 1.2.1 2.4.4 | Б | 2 | 2–3 |
| 8 | Характерные химические свойства неорганических веществ: – простых веществ-металлов: щелочных, щелочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) | 2.2 2.3 2.4 2.5 2.6 2.7 | 2.3.3 | П | 2 | 5–7 |
| 9 | Характерные химические свойства неорганических веществ: – простых веществ-металлов: щелочных, щелочноземельных, магния, алюминия, переходных металлов (меди, цинка, хрома, железа); – простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; – оксидов: оснóвных, амфотерных, кислотных; – оснований и амфотерных гидроксидов; – кислот; – солей: средних, кислых, оснóвных; комплексных (на примере гидроксосоединений алюминия и цинка) | 2.2 2.3 2.4 2.5 2.6 2.7 | 2.3.3 2.4.3 2.4.4 | П | 2 | 5–7 |
| 10 | Взаимосвязь неорганических веществ | 2.8 | 2.3.3 2.4.3 | Б | 2 | 2–3 |
| 11 | Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная) | 3.3 | 2.2.6 | Б | 1 | 2 |
| 12 | Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа | 3.1 3.2 | 1.2.1 2.2.2 2.2.3 2.2.7 | Б | 1 | 2 |
| 13 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории) | 3.4 4.1.7 | 2.3.4 1.3.4 2.5.1 | Б | 1 | 2 |
| 14 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих органических соединений (в лаборатории). | 3.5 3.6 4.1.8 | 2.3.4 1.3.4 2.5.1 | Б | 1 | 2 |
| 15 | Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Важнейшие способы получения аминов и аминокислот. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки | 3.7 3.8 | 2.3.4 | Б | 1 | 2 |
| 16 | Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Важнейшие способы получения углеводородов. Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии | 3.4 1.4.10 4.1.7. | 2.3.4 2.4.4 | П | 2 | 5–7 |
| 17 | Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола, альдегидов, карбоновых кислот, сложных эфиров. Важнейшие способы получения кислородсодержащих органических соединений | 3.5 3.6 4.1.8 | 2.3.4 | П | 2 | 5–7 |
| 18 | Взаимосвязь углеводородов, кислородсодержащих и азотсодержащих органических соединений | 3.9 | 2.3.4 2.4.3 | Б | 2 | 2–3 |
| 19 | Классификация химических реакций в неорганической и органической химии | 1.4.1 | 2.2.8 | Б | 1 | 2 |
| 20 | Скорость реакции, её зависимость от различных факторов | 1.4.3 | 2.4.5 | Б | 1 | 2 |
| 21 | Реакции окислительно-восстановительные. | 1.4.8 | 2.2.1 2.2.5 | Б | 1 | 5–7 |
| 22 | Электролиз расплавов и растворов (солей, щелочей, кислот) | 1.4.9 | 1.1.3 2.2.5 | П | 2 | 5–7 |
| 23 | Гидролиз солей.Среда водных растворов: кислая, нейтральная, щелочная | 1.4.7 | 2.2.4 | П | 2 | 5–7 |
| 24 | Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов | 1.4.4 | 2.4.5 | П | 2 | 5–7 |
| 25 | Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений | 4.1.4 4.1.5 | 2.5.1 | П | 2 | 5–7 |
| 26 | Правила работы в лаборатории. Лабораторная посуда и оборудование. Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами бытовой химии. Научные методы исследования химических веществ и превращений.Методы разделения смесей и очистки веществ. Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение окружающей среды и его последствия. Природные источники углеводородов, их переработка. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки | 4.1.1 4.1.2 4.2.1 4.2.2 4.2.3 4.2.4 | 1.3.2 1.3.3 1.3.4 2.2.4 | Б | 1 | 5–7 |
| 27 | Расчёты с использованием понятия «массовая доля вещества в растворе» | 4.3.1 | 2.5.2 | Б | 1 | 2 |
| 28 | Расчёты объёмных отношений газов при химических реакциях. Расчёты по термохимическим уравнениям | 4.3.2 4.3.4 | 2.5.2 | Б | 1 | 2 |
| 29 | Расчёты массы вещества или объема газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ | 4.3.3 | 2.5.2 | Б | 1 | 2 |
| Часть 2 | ||||||
| 30 | Реакции окислительно-восстанови-тельные | 1.4.8 | 2.2.5 2.4.4 | В | 2 | 10–15 |
| 31 | Реакции ионного обмена. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты | 1.4.5 1.4.6 | 2.2.4 2.4.4 | В | 2 | 10–15 |
| 32 | Реакции, подтверждающие взаимосвязь различных классов неорганических веществ | 2.8 | 2.3.3 2.4.3 2.4.4 | В | 4 | 10–15 |
| 33 | Реакции, подтверждающие взаимосвязь органических соединений | 3.9 | 2.3.4 2.4.3 | В | 5 | 10–15 |
| 34 | Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе». Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси). Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси | 4.3.1 4.3.5 4.3.6 4.3.8 4.3.9 | 2.5.2 | В | 4 | 10–15 |
| 35 | Установление молекулярной и структурной формулы вещества | 4.3.7 | 2.5.2 | В | 3 | 10–15 |
| Всего заданий – 35; из них по уровню сложности: Б – 21,П – 8; В – 6. Максимальный первичный балл за работу – 60. Общее время выполнения работы – 210 мин. | ||||||
Извлечения из Методических рекомендаций Рособрнадзора по формированию
и организации работы предметных комиссий субъекта Российской Федерации при проведении государственной итоговой аттестации по образовательным программам среднего общего образования
Во время работы экспертам запрещается:
· иметь при себе средства связи, фото-, аудио- и видеоаппаратуру;
· копировать и выносить из помещений, в которых работает ПК, экзаменационные работы, критерии оценивания, протоколы проверки экзаменационных работ;
· разглашать информацию, содержащуюся в указанных материалах.
Также запрещается:
· без уважительной причины покидать аудиторию;
· переговариваться с другими экспертами ПК, если речь не идет о консультировании с председателем ПК или с экспертом ПК, назначенным по решению председателя ПК, консультантом.
Если у эксперта возникают вопросы или проблемы, он должен обратиться к председателю ПК или лицу, назначенному председателем ПК консультантом.
 2020-04-20
2020-04-20 7337
7337
