проводя экспериментов; тепловые эффекты неосуществимых процессов и процессов, для которых тепловой эффект нельзя определить опытным путём.
Уравнение химической реакции с указанием теплового эффекта называется термохимическим уравнением. С термохимическими уравнениями можно обращаться так же, как и с алгебраическими уравнениями (складывать, умножать, делить).
Первое следствие из закона Гесса: тепловой эффект обратной реакции равен по величине и противоположен по знаку тепловому эффекту прямой реакции.
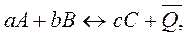
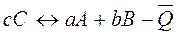 .
.
Второе следствие из закона Гесса: тепловой эффект реакции равен сумме теплот (энтальпий) образования продуктов реакций за вычетом (минус) суммы теплот (энтальпий) образования исходных веществ.
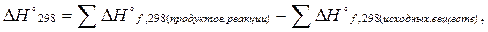 (3.3) здесь индекс f от лат. foramentum – образование.
(3.3) здесь индекс f от лат. foramentum – образование.
Например, для реакции aA + bB→cC + dD,
∆Hº 298 = (с∆Hºf, 298 ( C) + d∆Hºf, 298 ( D)) – (a∆Hºf, 298 ( A) + b∆Hºf, 298 ( B)).
При суммировании обязательно учитываются стехиометрические коэффициенты уравнения реакции.
Для расчета тепловых эффектов используются стандартные теплоты образования веществ. Стандартной теплотой (энтальпией) образования вещества ( 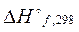 или
или 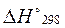 ) называетсяизменение энтальпии при образовании одного моль вещества из простых веществ, находящихся при стандартных условиях. Стандартная энтальпия простого вещества равна нулю.
) называетсяизменение энтальпии при образовании одного моль вещества из простых веществ, находящихся при стандартных условиях. Стандартная энтальпия простого вещества равна нулю.
|
|
|
Например, если вещество получено по реакции выраженной термохимическим уравнением
Ca(тв.) + C(графит) + 1,5O2(газ) = CaCO3(тв.) + 1207,7 Дж/моль,
его стандартная теплота образования равна
∆Hºf,298 (CaCO3)= - 1207,7 Дж/моль.
Третье следствие из закона Гесса: тепловой эффект реакцииравен сумме теплот сгорания исходных веществ за вычетом (минус) суммы теплот сгорания продуктов реакции.
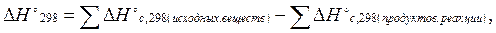 (3.4)
(3.4)
здесь индекс с от лат. combustum - сгорание.
Например, для реакции aA + bB→cC + dD,
∆H298 = a∆Hºс,298(A) + b∆Hºс,298(B) - c∆Hºс,298(C) - d∆Hºс,298(D).
Стандартная теплота сгорания вещества (∆Hºс,298, ∆Hºсгор. ) – это убыль энтальпии в реакции сгорания одного моль простого вещества или соединения до соответствующих окисленных форм элементов. В случае сгорания соединений, состоящих из углерода и водорода (например, топливо) до CO2 и H2O. Стандартные теплоты сгорания и образования приведены в справочных таблицах термодинамических величин.
Закон Кирхгофа устанавливает зависимость теплового эффекта реакции от температуры. Формулировка закона: температурный коэффициент теплового эффекта реакции равен изменению теплоемкости в результате процесса.
Уравнение Кирхгофа для изобарного процесса (р = const):
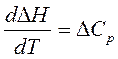 , (3.5)
, (3.5)
где 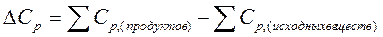 .
.
В зависимости от знака ∆Cр тепловой эффект реакции (процесса) с ростом температуры может увеличиваться или уменьшаться.
|
|
|
1) Если ∆Cp > 0, то с ростом температуры ∆H увеличивается.
2) Если ∆Cp < 0, то с ростом температуры ∆H уменьшается.
3) Если ∆Cp = 0, то тепловой эффект не зависит от температуры.
Проинтегрируем уравнение Кирхгоффа d∆H = ∆CрdT.
1. Пусть теплоемкость Ср не зависит от температуры, т.е. ∆Ср = const,
что допустимо в небольшом интервале температур.
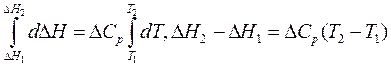 .
.
Отсюда выведем формулу для вычисления теплового эффекта:
∆H2 = ∆H1 + ∆Cр(T2 – T1). (3.6)
2. Пусть теплоемкость ∆Cр – является функцией от температуры, т.е.
∆Cp = f(T). Эта зависимость выражается уравнениями:
Cp = a + bT + cT² или Cp = a + bT + 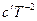 .
.
В общем виде изменение теплоемкости равно
∆Cp = ∆a + ∆bT + ∆cT² + 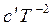 . (3.7)
. (3.7)
Подставим это выражение в уравнение Кирхгофа, тогда
d∆HТ = (∆a + ∆bT + ∆cT² +∆ 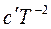 )dT.
)dT.
Возьмем неопределённый интеграл и получим выражение
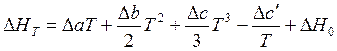 . (3.8)
. (3.8)
Уравнение (3.8) показывает зависимость теплового эффекта реакции от температуры. В нем ∆H0 – постоянная интегрирования, определяемая как значение теплового эффекта при одной из температур.
Уравнение Кирхгофа для изохорного процесса (V = const):
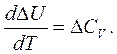 (3.9)
(3.9)
Задача.
Выразить зависимость теплового эффекта реакции от температуры, если известен тепловой эффект этой реакции при Т = 298 К и уравнение зависимости 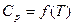 . Данные термодинамических величин приведены в справочнике.
. Данные термодинамических величин приведены в справочнике.
Реакция: 2СН4 + СО2 = СН3СОСН3(г) + Н2О(г) протекает при 500 К.
Решение. В основе решения – развернутое уравнение Кирхгофа (3.7):
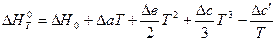 .
.
Для определения 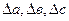 и
и 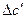 надо знать зависимость
надо знать зависимость 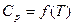 для каждого из исходных веществ и продуктов реакции:
для каждого из исходных веществ и продуктов реакции: 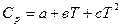 или
или 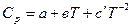 .
.
Для нахождения постоянной интегрирования надо знать тепловой эффект реакции при температуре 298:
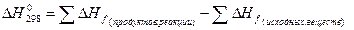 .
.
Порядок расчета.
1. Данные из справочника заносим в таблицу.
Таблица 2 Термохимические величины веществ
 , Дж/кмоль , Дж/кмоль
| 
| 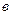
| 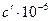
| 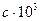
| Температурный интервал | |
| Дж/(кмоль·К) | ||||||
| Н2О | -242,000 | 30,146 | 11,305 | - | - | 273-2000 |
| СН3СОСН3(г) | -216,796 | 22,489 | 201,926 | - | -6,576 | 298-1500 |
| СО2 | -393,796 | 44,173 | 9,044 | -8,541 | - | 298-2500 |
| СН4 | -74,901 | 17,484 | 60,502 | - | -1,118 | 240-1500 |
2. Находим тепловой эффект реакции при Т = 298 К.
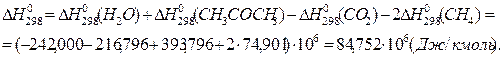
3. Находим  в общем виде.
в общем виде.
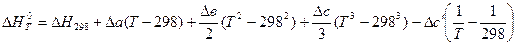 .
.
Принимает Т = 0. 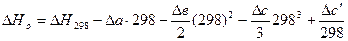 .
.
4. Находим 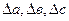 и
и 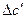 .
.
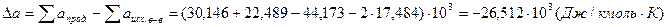
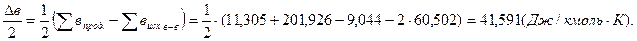
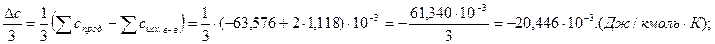
 .
.
5. Вычисляем 
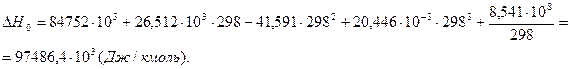
6. Находим теоретическую зависимость теплового эффекта реакции от температуры
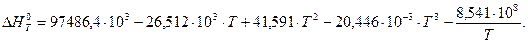
7. Определим тепловой эффект при Т = 500 К.
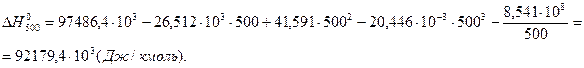
8. Определим насколько при температуре Т отличается 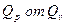 .
.
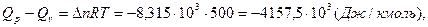
где 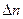 - число кмоль продуктов реакции минус число кмоль исходных веществ в газообразном состоянии;
- число кмоль продуктов реакции минус число кмоль исходных веществ в газообразном состоянии; 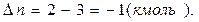 .
.
 2014-02-04
2014-02-04 3403
3403
