МАТЕРИАЛОВЕДЕНИЕ
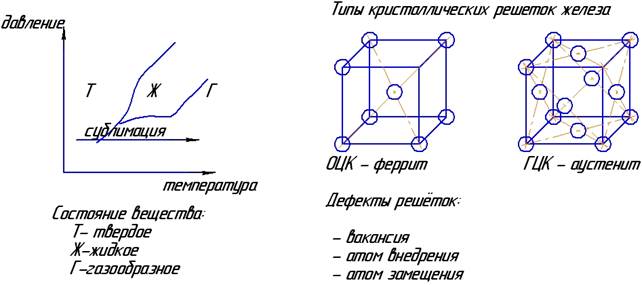
Вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Переход из твёрдого состояния в газообразное называется сублимацией.
Все металлы являются телами кристаллическими.
Для каждого металла характерна своя пространственно- кристаллическая решетка с дальним порядком расположения атомов (определенное расположение атомов на любом расстоянии).
В твердых телах порядок расположения атомов закономерен. Расположение атомов можно представить в виде элементарных кристаллических ячеек. Всего существует 14 типов решеток: для металлов характерны 3 типа:
1. Объемно - центрированная кубическая (ОЦК);
2. Гране - центрированная кубическая (ГЦК);
3. Гексагональная плотно упакованная (ГПУ).
Железо имеет два варианта кристаллических решеток:
- объемно-центрированную кубическую: атомы располагаются в центре куба и по его вершинам;
- гранецентрированную кубическую: атомы располагаются в центрах граней и по вершинам куба.
Ряд металлов изменяет тип кристаллической решетки при изменении температуры, такое свойство металлов называется полиморфизмом (многоформие, аллотропия). Для железа (Fe) при температуре до 911 °C - ОЦК; от 911 до 1392 °C - ГЦК; свыше 1392 °C - ОЦК.
Металлы состоят из большого числа кристаллов неправильной формы, которые называются зернами. В реальных металлах кристаллическая решетка не является идеальной. Внутренняя структура зерна имеет дефекты.
Дефекты кристаллической решетки:
1. Точечные (нульмерные);
2. Линейные (одномерные);
3. Поверхностные (двухмерные);
4. Объемные (трехмерные).
Незанятые атомами места называются «вакансией». Атомы других элементов могут замещать атомы или внедрятся в решетку. Монолитность сварных соединений обеспечивается появлением атомно-молекулярных связей между элементарными частицами соединяемых веществ: ковалентной, ионной, межмолекулярной, металлической. Для соединения материалов необходимо обеспечить контакт по стыкуемой поверхности и активизировать ее. Энергия активации соединяемым поверхностям передается в виде теплоты, упругопластической деформации, электронного или иного вида облучения. Энергия необходима для обрыва связей между атомами вещества и внешней средой, а также для перехода их в активное состояние.
Металлическая связь (решетка) характеризуется достаточной прочностью и пластичностью и зависит от типа и количества элементов решетки.
К объемным дефектам относятся трещины, непровары, несплавления, поры, шлаки (имеют значительные размеры в 3-х измерениях).
Упрощённая классификацияжелезоуглеродистых сплавов
Условно считается, что железоуглеродистые сплавы, содержащие менее 2,14% углерода – стали, более 2,14% - чугуны. К сплавам относят соединения, содержащие менее 50% железа.
Углеродистые стали в своем составе имеют железо и углерод. Для придания особых свойств в сталь вводят другие элементы. Такие стали называются легированными.
Углеродистые стали общего назначения поставляются:
группа А – с гарантируемыми механическими свойствами (сталь не подвергается термообработке);
группа Б - с гарантируемым химическим составом (сталь подвергается термообработке);
группа В - с гарантируемыми механическими свойствами и химическим составом.
Кипящие стали (кп) раскисляются Mn, полуспокойные (пс) – Mn, Si, спокойные (сп) – Mn, Si, Al.
Пример обозначения стали группы А – Ст.3кп, группы В –В Ст.3сп.
Качественные углеродистые стали отличаются пониженным содержанием вредных примесей – фосфора и серы. В обозначении сталей цифры означают содержание углерода в сотых долях процента, например – Сталь 10 содержит 0,10 % углерода.
Малоуглеродистые стали содержат углерода менее 0,25 %, среднеуглеродистые – 0,25…0,46 %, высокоуглеродистые – более 0,46 %.
Легирование позволяет повысить прочностные свойства, обеспечивает коррозионную стойкость, жаропрочность и т.п. В зависимости от содержания легирующих элементов стали разделяются на низколегированные (до 2,5 %), среднелегированные (2,5…10 %) и высоколегированные (более 10 %).
Легирующие добавки имеют следующие условные обозначения: марганец - Г, кремний - С, никель - Н, хром - Х, молибден - М, ванадий - Ф и т.д.
Первые две цифры в обозначении стали указывают на содержание углерода в сотых долях процента, а цифра справа от условного обозначения элемента – среднее содержание элемента в процентах. Пример обозначения легированной стали: 12Х18Н9Т – 0,12% углерода, 18% хрома, 9% никеля, 1% титана.
Примечание. Буква А в середине обозначения стали – содержание азота, в конце – пониженное содержание вредных примесей.
Диаграмма состояния «Железо - Углерод»
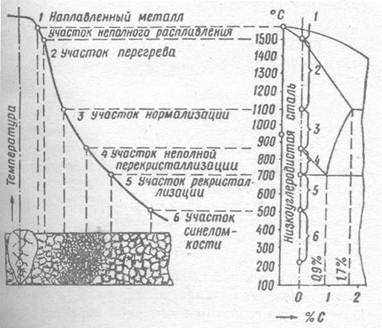 |
Представляет собой графическое изображение состояния сплава. Координатором является температура концентрации. Диаграмма состояния строится для равновесных условий, она позволяет определить фазовое состояние для заданных условий. Фазой называется однородная часть системы, отделенная от других частей системы границей раздела при переходе через которую свойства меняются скачкообразно.
Железо в твердом состоянии может иметь две кристаллические модификации:
• До 911 °C - ОЦК (альфа - железо)
• Св. 911 °C железо претерпевает полиморфное превращение, приобретая решетку ГЦК (гамма - железо), и сохраняет это состояние до 1392 °C.
• При температуре 1392 °C происходит полиморфное превращение с образованием ОЦК (дельта - железо)
• При нагреве до температуры 1539 °C - образуется жидкая фаза.
Растворимость углерода в железе зависит от типа кристаллической решетки и температуры. В альфа - железе при 20 °C растворяется 0,01 % углерода, при 727 °C -0,02 %. В гамма - железе при температуре 1147 °C растворяется до 2,14% углерода.
Стали подразделяют на доэвтектоидные и заэвтектоидные. В зависимости от содержания углерода стали подразделяют на: низкоуглеродистые (с содержанием углерода до 0,25 % включительно); среднеуглеродистые (от 0,25 % до 0,45 % углерода); высокоуглеродистые (более 0,45 %). В группе высокоуглеродистых сталей выделяют инструментальные стали (С=0,7 - 1,3 %) У7, У8, У13.
С увеличением концентрации С, возрастает прочность и твердость стали, со снижением пластичности.
В т. А2 при температуре 768 исчезают магнитные свойства железа.
 2014-02-02
2014-02-02 4004
4004
