Переваривание белков происходит в желудке и в тонком кишечнике Переваривание белков в желудочно-кишечном тракте имеет ряд особенностей:
- протеолитические ферменты выделяются в неактивном состоянии (защитный механизм от переваривания тканевых белков)
- их активирование происходит в просвете желудочно-кишечного тракта путём частичного протеолиза
- протеазы желудочно–кишечного тракта отличаются субстратной специфичностью, могут относиться или к эндопептидам, или экзопептидазам
В желудке основным ферментом, расщепляющим белки, является пепсин. Он выделяется в неактивном состоянии в виде профермента пепсиногена. Под действием HCl происходит частичный протеолиз пепсиногена и превращение его в активную форму пепсин. При частичном протеолизе происходит изменение структуры фермента, обнажение его активного центра.
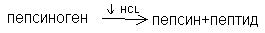
Пепсин относится к эндопептидазам, разрывает внутренние пептидные связи в белках, образованные тирозином, фенилаланином.
Роль HCl в переваривании белков:
- специфичный активатор пепсиногена
- обеспечивает оптимум рН для пепсина (рН = 1-2)
- вызывает частичную денатурацию белка
- является бактерицидным барьером
Слизистая желудка имеет целый ряд защитных механизмов от агрессивного действия пепсина и соляной кислоты:
a) выработка слизи (основной её компонент гликозаминогликаны)
b) выделение пепсина в неактивном состоянии
c) выделение бикарбонатов, нейтрализующих HCl
У детей процессы переваривания белков в желудке менее активны, чем у взрослых, так как снижена активность пепсина и продукция соляной кислоты. У грудных детей в желудке кроме пепсина в переваривании белков участвуют ферменты химозин (фермент, створаживающий молоко), гастриксин (оптимум рН 4-5 ), катепсины, а также протеазы грудного молока. В желудке происходит частичное переваривание белков до пептидов.
Дальнейшее переваривание белков осуществляется в тонком кишечнике под действием ферментов поджелудочной железы и собственных ферментов слизистой оболочки кишечника. К ферментам поджелудочной железы относятся трипсин, химотрипсин, эластаза, карбоксипептидазы. Трипсин выделяется поджелудочной железой в неактивном состоянии в виде трипсиногена, 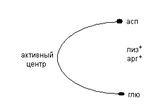 который активируется ферментом энтеропептидазой (энтерокиназой), вырабатываемой слизистой кишечника. Активация трипсиногена происходит путём частичного протеолиза с отщеплением 6 аминокислот и освобождением активного центра. В активном центре трипсина в зоне связывания преобладают кислые аминокислоты (глю, асп), поэтому трипсин расщепляет в пищевых белках пептидные связи, образованные лизином и аргинином. Трипсин, в свою очередь, активирует другие протеолитические ферменты. Химотрипсин вырабатывается в неактивном состоянии в виде химотрипсиногена, активируется трипсином путём частичного протеолиза. Химотрипсин относится к эндопептидазам, содержит в активном центре гидрофобные аминокислоты, расщепляет в белках связи, образованные ароматическими аминокислотами (фенилаланин, тирозин). Эластаза образуется из проэластазы под действием трипсина путём частичного протеолиза. В активном центре эластазы преобладает аминокислоты с разветвлённым радикалом, поэтому она расщепляет в белках связи, образованные глицином, не содержащим радикала. Карбоксипептидазы относятся к экзопептидазам, отщепляют от белков концевые аминокислоты. Карбоксипептидазы «А» отщепляют С-концевые ароматические аминокислоты (фенилаланин, тирозин, карбоксипептидазы «В» отщепляют С-концевые аминокислоты лизин и аргинин.
который активируется ферментом энтеропептидазой (энтерокиназой), вырабатываемой слизистой кишечника. Активация трипсиногена происходит путём частичного протеолиза с отщеплением 6 аминокислот и освобождением активного центра. В активном центре трипсина в зоне связывания преобладают кислые аминокислоты (глю, асп), поэтому трипсин расщепляет в пищевых белках пептидные связи, образованные лизином и аргинином. Трипсин, в свою очередь, активирует другие протеолитические ферменты. Химотрипсин вырабатывается в неактивном состоянии в виде химотрипсиногена, активируется трипсином путём частичного протеолиза. Химотрипсин относится к эндопептидазам, содержит в активном центре гидрофобные аминокислоты, расщепляет в белках связи, образованные ароматическими аминокислотами (фенилаланин, тирозин). Эластаза образуется из проэластазы под действием трипсина путём частичного протеолиза. В активном центре эластазы преобладает аминокислоты с разветвлённым радикалом, поэтому она расщепляет в белках связи, образованные глицином, не содержащим радикала. Карбоксипептидазы относятся к экзопептидазам, отщепляют от белков концевые аминокислоты. Карбоксипептидазы «А» отщепляют С-концевые ароматические аминокислоты (фенилаланин, тирозин, карбоксипептидазы «В» отщепляют С-концевые аминокислоты лизин и аргинин.
К ферментам кишечника относятся аминопептидазы и дипептидазы. Аминопептидазы – экзопептидазы, отщепляют N-концевые аминокислоты. К аминопептидазам относится, в частности, лейцинаминопептидаза (ЛАП). Дипептидазы кишечника расщепляет дипептиды. В тонком кишечнике происходит полное гидролитическое расщепление пищевых белков до аминокислот. Образовавшиеся аминокислоты подвергаются всасыванию. У детей снижена активность протеолитических ферментов слизистой кишечника и поджелудочной железы.
 2014-02-02
2014-02-02 5195
5195
